题目内容
15.下列叙述正确的是( )| A. | 已知常温下0.1mol•L-1NaClO溶液pH为9.7则水解方程式ClOˉ+H2O?HClO+OHˉ的平衡常数K≈10ˉ7.6 | |
| B. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 | |
| D. | 25℃时,pH=4,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
分析 A.pH为9.7的溶液中的氢氧根离子浓度为10-4.3mol/L,次氯酸根离子的浓度约为0.1mol/L,次氯酸的浓度与氢氧根离子浓度近似相等,根据水解方程式ClO-+H2O?HClO+OH-的平衡常数为K=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$,计算;
B.设溶液体积为1L,HCl的物质的量为0.2mol,偏铝酸钾的物质的量为0.1mol,0.1mol偏铝酸钾与0.1molHCl反应生成0.1mol氢氧化铝沉淀,剩余的0.1molHCl能够溶解$\frac{0.1mol}{3}$氢氧化铝生成$\frac{0.1mol}{3}$铝离子,溶液呈酸性,但是氢离子浓度c(H+)<c(Al3+);
C.pH=-lgc(H+),溶液的pH相等,则氢离子浓度相等;
D.混合液的pH=4,则c(OH-)<c(H+),根据电荷守恒可知c(Na+)<c(CH3COO-),结合电荷守恒判断.
解答 解:A.pH为9.7的溶液中的氢氧根离子浓度为:10-4.3mol/L,水解方程式ClO-+H2O?HClO+OH-的平衡常数为K=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$≈$\frac{1{0}^{-4.3}×1{0}^{-4.3}}{0.1}$=10-7.6,故A正确;
B.设溶液体积为1L,1L 0.2mol/L的盐酸中含有HCl的物质的量为0.2mol,1L 0.1mol/L的偏铝酸钾溶液中含有偏铝酸钾的物质的量为0.1mol,0.1mol偏铝酸钾与0.1molHCl反应生成0.1mol氢氧化铝沉淀,剩余的0.1molHCl能够溶解$\frac{0.1mol}{3}$氢氧化铝生成$\frac{0.1mol}{3}$铝离子,则铝离子的浓度大于氢离子,正确的离子方程式为:c(OH-)<c(H+)<c(Al3+)<c(K+)<c(Cl-),故B错误;
C.pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)相等,都是10-5mol/L,故C错误;
D.25℃时,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液的pH=4,则c(OH-)<c(H+),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知c(Na+)<c(CH3COO-),则c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握弱电解质的电离、盐的水解原理,能够根据电荷守恒、物料守恒判断离子浓度大小,试题培养了学生的分析能力及灵活应用能力.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案①c(H+)的物质的量浓度 ②c(OH-)的物质的量浓度 ③$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ ④水的浓度⑤c(H+)•c(OH-)( )
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ②⑤ |
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| C. | CH3CH3的二溴代烷有2种,则CH3CH3的四溴代烷也是2种 | |
| D. | 用-C3H7取代甲苯苯环上的1个氢原子,所得芳香烃的数目是三种 |
| A. | 离子化合物中的阳离子只能是金属离子 | |
| B. | 离子化合物中一定含有离子键 | |
| C. | 离子化合物都能溶于水,其水溶液可以导电 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
| A. | 乙元素的族序数比甲元素的族序数小 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 | |
| C. | 原子半径由大到小的顺序为:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
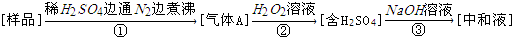
| A. | 亚硫酸盐作为食品添加剂作用是防腐、抗氧化 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |

 ,CCH2═CHCN.
,CCH2═CHCN.