题目内容
3.在一定的温度下,向CH3COOH溶液里加水稀释,下列组数据变大的是①c(H+)的物质的量浓度 ②c(OH-)的物质的量浓度 ③$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ ④水的浓度⑤c(H+)•c(OH-)( )
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ②⑤ |
分析 CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大,所以c(H+)减小,Kw不变,则c(OH-)增大,以此解答该题.
解答 解:①加水稀释,溶液体积增大,c(H+)的物质的量浓度减小,故错误;
②c(H+)的物质的量浓度减小,由于c(H+)•c(OH-)不变,则c(OH-)的物质的量浓度 增大,故正确;
③加水稀释,促进醋酸的电离,溶液中n(CH3COOH)减小,n(CH3COO-)增大,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故正确;
④水为溶剂,加水稀释后,水的浓度不会变化,故错误;
⑤由于温度不变,所以水的离子积不变,即c(H+)•c(OH-)的值不会变化,故⑤错误;
故选B.
点评 本题考查了弱电解质的电离、水的离子积等,为股票开车,侧重于学生的分析能力的考查,题目难度不大,注意弱电解质浓度越小电离程度越大,侧重于考查学生的分析能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
| a(干燥气体) | b(液体) | 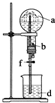 | |
| A | NO | 水 | |
| B | CO2 | 4mol•L-1NaOH溶液 | |
| C | Cl2 | 饱和NaCl溶液 | |
| D | NH3 | 热的浓的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.有机物:①正戊烷 ②异戊烷 ③新戊烷 ④正丁烷⑤异丁烷,它们的沸点按由低到高的顺序排列正确的是( )
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
18.下列说法正确的是( )
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,只能软化暂时硬水,不能软化永久硬水 | |
| D. | 只具有暂时硬度的水经加热煮沸后,可变成软水 |
8.某元素Mn+核外共有x个电子,该原子质量数为a,则该原子核内含有的中子数为( )
| A. | a-x+n | B. | a+x+n | C. | a-n+x | D. | a-x-n |
15.下列叙述正确的是( )
| A. | 已知常温下0.1mol•L-1NaClO溶液pH为9.7则水解方程式ClOˉ+H2O?HClO+OHˉ的平衡常数K≈10ˉ7.6 | |
| B. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 | |
| D. | 25℃时,pH=4,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
13. 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态原子Ti有7种能量不同的电子,基态Ti3+的未成对电子有1个.
②LiBH4由Li+和BH4-构成,BH4-的立体构型是sp3杂化,LiBH4中不存在的作用力
有c(填字母).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
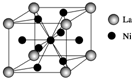
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料.
①H3BNH3的等电子体的化学式为C2H6.
②镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=5.氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石.则在下列各项中,立方氮化硼晶体不可用作c(填字母).
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头.
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态原子Ti有7种能量不同的电子,基态Ti3+的未成对电子有1个.
②LiBH4由Li+和BH4-构成,BH4-的立体构型是sp3杂化,LiBH4中不存在的作用力
有c(填字母).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料.
①H3BNH3的等电子体的化学式为C2H6.
②镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=5.氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石.则在下列各项中,立方氮化硼晶体不可用作c(填字母).
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头.
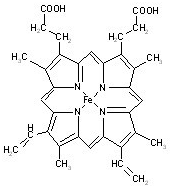 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.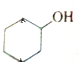 )中有3个手性碳原子.
)中有3个手性碳原子.