题目内容
16.下列反应的离子方程式书写正确的是( )| A. | 大理石和盐酸的反应:CO32ˉ+2H+═CO2↑+H2O | |
| B. | KI溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| C. | 三氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| D. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OHˉ═SiO32ˉ+H2O |
分析 A.大理石的主要成分为碳酸钙,碳酸钙为难溶物,不能拆开;
B.酸性条件下,反应产物中不能生成氢氧根离子;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水.
解答 解:A.大理石和盐酸的反应中,碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.KI溶液中加入硫酸酸化的过氧化氢溶液,二者发生氧化还原反应,正确的离子方程式为:2H++2I-+H2O2═I2+2H2O,故B错误;
C.三氯化铁溶液与铁反应生成氯化亚铁,正确的离子方程式为:2Fe3++Fe═3Fe2+,故C错误;
D.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OHˉ═SiO32ˉ+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;试题培养了学生的灵活应用能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
14.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有碳酸根离子 | |
| B. | 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 | |
| C. | 称量氢氧化钠固体的质量时,将称量物放在烧杯中,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| D. | 向某溶液中滴加NaOH溶液,溶液中出现蓝色沉淀,该溶液中一定含Cu2+ |
7.下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7
②用HF溶液做导电性实验,灯泡很暗
③常温下0.1mol/L的HF溶液的pH为2.3
④HF能与Na2CO3溶液反应,产生CO2气体
⑤HF与水能以任意比混溶
⑥1mol/L的HF水溶液能使紫色石蕊试液变红.
①常温下NaF溶液的pH大于7
②用HF溶液做导电性实验,灯泡很暗
③常温下0.1mol/L的HF溶液的pH为2.3
④HF能与Na2CO3溶液反应,产生CO2气体
⑤HF与水能以任意比混溶
⑥1mol/L的HF水溶液能使紫色石蕊试液变红.
| A. | ①③ | B. | ②③⑤ | C. | ④⑥ | D. | ①②⑤ |
4.下列防止金属腐蚀的做法不可行的是( )
| A. | 在某些工具的机械转动部位刷油漆以防锈 | |
| B. | 自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 | |
| C. | 自行车车辐条上的镀锌层部分破损,还可以为铁提供保护 | |
| D. | 钢铁在潮湿的环境中更易生锈,要在电线外面包上一层塑料层以防锈 |
11.某溶液中有NH4+、Mg2+、Fe2+、Fe3+和NO3-五种离子,向该溶液的中加入过量的氢氧钠溶液,微热并搅拌,再加入过量盐酸,则溶液中大量减少的阳离子是( )
①Fe3+②Mg2+③Fe2+④NH4+.
①Fe3+②Mg2+③Fe2+④NH4+.
| A. | 只有①③ | B. | 只有①④ | C. | 只有②④ | D. | 只有③④ |
1.下列装置或操作不能达到目的是( )
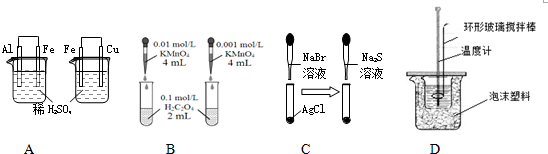

| A. | 依据左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡,判断活动性:Al>Fe>Cu | |
| B. | 依据褪色快慢比较浓度对反应速率的影响 | |
| C. | 依据白色固体先变为淡黄色,后变为黑色(Ag2S),判断溶解性:AgCl>AgBr>Ag2S | |
| D. | 用该装置测定中和热 |
8.下列反应的离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-?+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-?+H2↑ | |
| C. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
5. 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )| A. | 反应开始到t2时,反应达到平衡状态 | |
| B. | 反应开始到t1(t1=1s),N的物质的量浓度变化了2mol/L | |
| C. | 反应开始到t2(t2=2s),用M表示反应速率为0.5mol/(L.s) | |
| D. | 反应的化学方程式为:N(g)?2M(g) |

 体会变为红棕色
体会变为红棕色