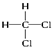
题目内容
8.下列反应的离子方程式书写正确的是( )| A. | 钠和冷水反应:Na+2H2O═Na++2OH-?+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-?+H2↑ | |
| C. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒;
B.2mol铝与氢氧化钠溶液反应生成3mol氢气,该反应不满足电子守恒和电荷守恒;
C.铁与稀硫酸反应生成的是亚铁离子;
D.氯化亚铁与氯气反应生成氯化铁.
解答 解:A.钠和冷水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.金属铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.铁跟稀硫酸反应生成的是硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故C错误;
D.FeCl2溶液跟Cl2反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
点评 本题考查了离子方程式的书写方法,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握电荷守恒、电子守恒在判断离子方程式正误中的应用,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
19.有关下列电化学装置的说法中正确的是( )
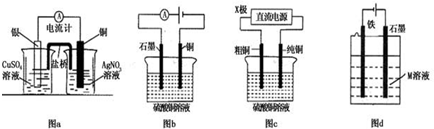

| A. | 图a是原电池装置,且较长时间内,电流计会显示有稳定电流产生 | |
| B. | 图b 电解足量硫酸铜溶液一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度 | |
| C. | 图c中的X极若为负极,则该装置可实现粗铜的精炼 | |
| D. | 图d中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀 |
16.下列反应的离子方程式书写正确的是( )
| A. | 大理石和盐酸的反应:CO32ˉ+2H+═CO2↑+H2O | |
| B. | KI溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| C. | 三氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| D. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OHˉ═SiO32ˉ+H2O |
3.镁、铝、铁三种金属分别与足量的盐酸反应,生成相同质量的氢气,则参加反应的三种金属( )
| A. | 物质的量相等 | B. | 失去电子的物质的量相等 | ||
| C. | 质量比为24:27:26 | D. | 质量比为12:18:28 |
17.下列说法正确的是( )
| A. | 我们常用的元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 元素周期表中同一横行元素原子的电子层数相同 | |
| C. | 元素周期表有16个纵行 | |
| D. | 元素周期表已发展成一个稳定的形式,它不可能再有新的变化了 |
 C.12C和13C
C.12C和13C  和
和