题目内容
7.下列事实一定能说明HF是弱酸的是( )①常温下NaF溶液的pH大于7
②用HF溶液做导电性实验,灯泡很暗
③常温下0.1mol/L的HF溶液的pH为2.3
④HF能与Na2CO3溶液反应,产生CO2气体
⑤HF与水能以任意比混溶
⑥1mol/L的HF水溶液能使紫色石蕊试液变红.
| A. | ①③ | B. | ②③⑤ | C. | ④⑥ | D. | ①②⑤ |
分析 弱电解质在溶液中部分电离,存在电离平衡,要说明HF是弱电解质,只要能证明HF部分电离即可,注意酸的溶解性及酸的通性无法确定酸电离的程度,据此进行解答.
解答 解:①常温下碱性溶液中pH>7,NaF溶液的pH大于7说明呈碱性,说明NaF发生了水解,HF是弱酸,故①正确;
②导电性强弱主要与离子浓度有关,不能说明HF是弱酸,故②错误;
③常温下0.1mol/L的HF溶液的pH为2.3说明HF部分电离是弱酸,故③正确;
④HF能与Na2CO3溶液反应,产生CO2气体说明HF的酸性比碳酸的强,不能说明HF是弱酸,故④错误;
⑤HF与水能以任意比混溶,属于氟化氢的物理性质,与HF的酸性强弱无关,故⑤错误;
⑥1mol/L的HF水溶液能使紫色石蕊试液变红说明HF水溶液显酸性,不能说明HF是弱酸,故⑥错误;
故选A.
点评 本题考查了弱电解质的判断,题目难度不大,熟练掌握弱电解质的特征“部分电离”是解答本题的关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
5.下列叙述正确的是( )
| A. | 烃类分子中的碳原子与其他原子间通过非极性键结合 | |
| B. | 烷烃是饱和的链烃,分子中碳原子不可能在同一平面上 | |
| C. | 甲烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| D. | 烷烃的沸点随碳原子数增加而逐渐升高 |
2.下列说法不正确的是( )
| A. | 除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 | |
| B. | 除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 | |
| C. | CH4和CCl4中的化学键均为非极性键,CH4、CCl4都是正四面体结构 | |
| D. | 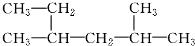 系统命名法为:2,4-二甲基-己烷 系统命名法为:2,4-二甲基-己烷 |
12.下列反应是氧化还原反应的是( )
| A. | CO2+Ca(OH)2=CaCO3↓+H2O | B. | SO3+H2O=H2SO4 | ||
| C. | 2KMnO4=K2MnO4+MnO2+O2↑ | D. | 2NaHCO3=Na2CO3+CO2↑+H2O |
19.有关下列电化学装置的说法中正确的是( )
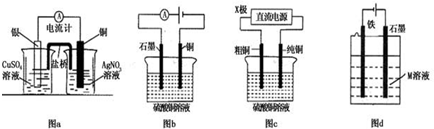

| A. | 图a是原电池装置,且较长时间内,电流计会显示有稳定电流产生 | |
| B. | 图b 电解足量硫酸铜溶液一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度 | |
| C. | 图c中的X极若为负极,则该装置可实现粗铜的精炼 | |
| D. | 图d中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀 |
16.下列反应的离子方程式书写正确的是( )
| A. | 大理石和盐酸的反应:CO32ˉ+2H+═CO2↑+H2O | |
| B. | KI溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| C. | 三氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| D. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OHˉ═SiO32ˉ+H2O |
17.下列说法正确的是( )
| A. | 我们常用的元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 元素周期表中同一横行元素原子的电子层数相同 | |
| C. | 元素周期表有16个纵行 | |
| D. | 元素周期表已发展成一个稳定的形式,它不可能再有新的变化了 |
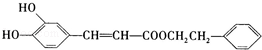 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: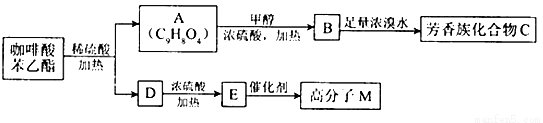
 条件下1molA最多能与1mol氢气加成
条件下1molA最多能与1mol氢气加成