题目内容
5. 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )| A. | 反应开始到t2时,反应达到平衡状态 | |
| B. | 反应开始到t1(t1=1s),N的物质的量浓度变化了2mol/L | |
| C. | 反应开始到t2(t2=2s),用M表示反应速率为0.5mol/(L.s) | |
| D. | 反应的化学方程式为:N(g)?2M(g) |
分析 由图可知,N的物质的量减少,M的物质的量增大,且N、M的物质的量的变化量之比为(8-4):(4-2)=2:1,图中t3时为平衡状态,反应为2N(g)?M(g),结合c=$\frac{n}{V}$、v=$\frac{△c}{△t}$计算.
解答 解:由图可知,N的物质的量减少,M的物质的量增大,且N、M的物质的量的变化量之比为(8-4):(4-2)=2:1,t3时为平衡状态,反应为2N(g)?M(g),
A.反应开始到t2时,M、N的物质的量还在变化,没有达到平衡状态,故A错误;
B.反应开始到t1(t1=1s),N的物质的量浓度变化了$\frac{8mol-6mol}{2L}$=1mol/L,故B错误;
C.反应开始到t2(t2=2s),用M表示反应速率为$\frac{\frac{4mol-2mol}{2L}}{2s}$=0.5mol/(L.s),故C正确;
D.由上述分析可知,反应为2N(g)?M(g),故D错误;
故选C.
点评 本题考查物质的量随时间变化曲线,为高频考点,把握图中物质的量的变化为解答的关键,侧重分析与应用能力的考查,注意速率及浓度的计算,题目难度不大.

练习册系列答案
相关题目
16.下列反应的离子方程式书写正确的是( )
| A. | 大理石和盐酸的反应:CO32ˉ+2H+═CO2↑+H2O | |
| B. | KI溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| C. | 三氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| D. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OHˉ═SiO32ˉ+H2O |
10.下列电离方程式错误的是( )
| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | H3PO4溶于水:H3PO4?3H++PO43- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- |
17.下列说法正确的是( )
| A. | 我们常用的元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 元素周期表中同一横行元素原子的电子层数相同 | |
| C. | 元素周期表有16个纵行 | |
| D. | 元素周期表已发展成一个稳定的形式,它不可能再有新的变化了 |
下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是SO3气体 |
B | 向某溶液中加入Cu 和浓H2SO4 | 试管 | 原溶液可能含有NO3- |
C | 将Na投到一定浓度的CuCl2溶液 | 出现气泡并有固体生成 | Na与CuCl2溶液反应,有H2和Cu生成 |
D | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2] >Ksp[Cu(OH)2] |
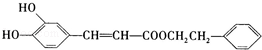 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: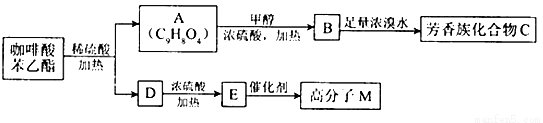
 条件下1molA最多能与1mol氢气加成
条件下1molA最多能与1mol氢气加成 C.12C和13C
C.12C和13C  和
和
 口有红棕色气体产生
口有红棕色气体产生