题目内容
5.微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
分析 银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答.
解答 解:A.负极发生Zn+2OH--2e=ZnO+H2O,c(OH-)减小,所以电池负极区溶液的pH减小,故A错误;
B.Zn为负极,Ag2O为正极,则使用过程中,电子由Zn极经外电路流向Ag20极,故B错误;
C.Zn失去电子,Zn为负极,Ag2O得到电子是正极,故C正确;
D.Zn电极失电子发生氧化反应,Ag2O电极得电子发生还原反应,故D错误;
故选C.
点评 本题考查原电池的工作原理,明确电极反应、正负极的判断、电子的流向即可解答,题目难度不大.

练习册系列答案
相关题目
15.下列说法中错误的是( )
| A. | 所有的化学反应都伴随着物质变化和能量变化 | |
| B. | 断裂化学键要吸收能量、形成化学键要释放能量是化学反应中能量变化的主要原因 | |
| C. | 吸热反应是一定需要加热才能发生的反应 | |
| D. | 根据反应物总能量和生成物总能量的相对大小可判断反应是释放能量还是吸收能量 |
16.已知元素Se位于第四周期ⅥA族,下列说法不正确的是( )
| A. | Se的原子序数为34 | B. | 单质Se在空气中燃烧可生成SeO3 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
13.下列叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子数总是从 1~8 重复出现 | |
| B. | 随着原子序数的递增,元素的最高正化合价从+1到+7,负价从-7到-1重复出现 | |
| C. | 第3周期中,随着核电荷数的递增,元素的离子半径依次减小 | |
| D. | 随核电荷数递增,ⅦA族元素单质熔、沸点升高,碱金属元素单质熔、沸点降低 |
20.下列说法中错误的是( )
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 溴单质与水的反应比氯单质与水的反应更剧烈 |
10.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 1mol冰中有2mol氢键 | |
| C. | 17.6g丙烷中所含的极性共价键为3.2NA个 | |
| D. | 1molH3O+含有11mol电子 |
17.分子中所有原子最外层都满足8电子稳定结构的化合物是( )
| A. | SiO2 | B. | N2 | C. | PCl5 | D. | COCl2 |
14.某同学利用下列实验探究金属铝与铜盐溶液反应:下列说法正确的是( )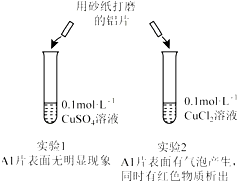

| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
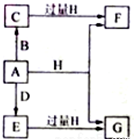 A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.
A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题. .
.