题目内容
14.某同学利用下列实验探究金属铝与铜盐溶液反应:下列说法正确的是( )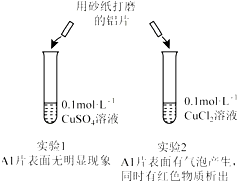
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
分析 A.没有明显现象,不能比较金属的活泼性;
B.电荷不守恒;
C.实验2现象明显,说明阴离子不同导致现象不同;
D.氢离子浓度不同,与本实验无关.
解答 解:A.没有明显现象,只能说明反应没发生,客观事实是金属活泼性是铝大于铜,故A错误;
B.生成红色固体的反应是2Al+3Cu2+═2Al3++3Cu,故B错误;
C.由实验1、2 的对比实验可知产生不同现象的原因是溶液中的阴离子不同导致的,故C正确;
D.铝片在等浓度的盐酸和硫酸中反应,因硫酸中的H+的浓度大,所以在硫酸中反应剧烈,与本实验无关,故D错误.
故选C.
点评 本题考查物质的性质探究实验,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验原理的探究,难度不大.

练习册系列答案
相关题目
4.分离下列混合物可按溶解、过滤、蒸发顺序进行的是( )
| A. | NaCl和KNO3 | B. | MnO2和 KCl | C. | 乙醇和水 | D. | CuO和MnO2 |
5.微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
19.元素的性质呈周期性变化的根本原因是( )
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
6.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的bd(填代号).
a.CuO b.NaOH c.Cu d..Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl.•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴
入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.
(已知:2Cu2++4I-=2CuI↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.
(已知:I2+2S2O32-=2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液.
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
③该样品中CuCl2•2H2O 的质量分数为$\frac{171cV×1{0}^{-3}×10}{m}$×100%(用含m、c、V的代数式表示,不用化简).

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的bd(填代号).
a.CuO b.NaOH c.Cu d..Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl.•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴
入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.
(已知:2Cu2++4I-=2CuI↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.
(已知:I2+2S2O32-=2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液.
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
③该样品中CuCl2•2H2O 的质量分数为$\frac{171cV×1{0}^{-3}×10}{m}$×100%(用含m、c、V的代数式表示,不用化简).
3.下列说法错误的是( )
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
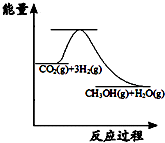 目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).
目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).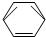 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH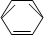 +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O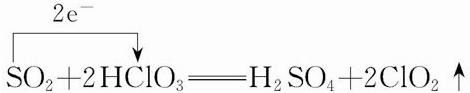 .
.