题目内容
10.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 1mol冰中有2mol氢键 | |
| C. | 17.6g丙烷中所含的极性共价键为3.2NA个 | |
| D. | 1molH3O+含有11mol电子 |
分析 A、标况下二氯甲烷为液态;
B、一个水分子能形成两条氢键;
C、求出丙烷的物质的量,然后根据1mol丙烷中含8mol极性共价键来分析;
D、H3O+为10电子微粒.
解答 解:A、标况下二氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子数,故A错误;
B、一个水分子能形成两条氢键,故1mol冰中含2mol氢键,故2NA个,故B正确;
C、17.6g丙烷的物质的量n=$\frac{17.6g}{44g/mol}$=0.4mol,而1mol丙烷中含8mol极性共价键,故0.4mol丙烷中含3.2mol极性共价键即3.2NA个,故C正确;
D、H3O+为10电子微粒,故1molH3O+中10NA,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
20.甲、乙两元素原子的L层电子数都是其他层电子总数的2倍,甲的原子半径大于乙的原子半径,下列说法正确是( )
| A. | 甲、乙处于同一周期 | |
| B. | 它们中有一种元素位于第ⅥA族 | |
| C. | 乙的最高价氧化物与甲的单质反应是吸热反应 | |
| D. | 简单甲离子的电子式为:Mg2+ |
1.下列有关烷烃的命名错误的是( )
| A. |  2甲基丁烷 2甲基丁烷 | B. |  2,2,4三甲基戊烷 2,2,4三甲基戊烷 | ||
| C. | (CH3CH2)2CHCH3 3甲基戊烷 | D. |  异戊烷 异戊烷 |
18.常温下,下列溶液中各组离子一定能大量共存的是( )
| A. | 加入铝粉有氢气生成的溶液中:Mg2+,Cl-,NO3-,K+ | |
| B. | 常温下,c(H+)=0.1 mol/L的溶液中:Na+,AlO2-、S2-、SO32- | |
| C. | 含有0.1 mol/LHCO3-的溶液:Na+,Fe3+,NO3-,SCN- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+,K+,CO32-,NO3- |
5.微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
19.元素的性质呈周期性变化的根本原因是( )
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
20.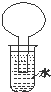 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后无变化 |
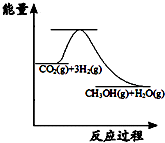 目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).
目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).