题目内容
4.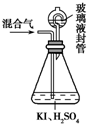 用如图装置可以测定混合气中ClO2的含量:
用如图装置可以测定混合气中ClO2的含量:ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
ⅲ.将一定量含ClO2的混合气体通入锥形瓶中吸收;
ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
ⅴ.用0.100 0mol•L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O.
②测得混合气中ClO2的质量为0.02700g.
分析 ①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
解答 解:①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②含有Na2S2O3物质的量为0.01L×0.2mol/L=0.002mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,所以m(ClO2)=0.004 mol×67.5g/mol=0.027 00g,
故答案为:0.027 00.
点评 本题考查制备ClO2、物质含量的测定,为高频考点,把握物质的性质、制备流程、发生的反应为解答的关键,侧重计算能力的综合考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,8 g甲烷中含C-H键的数目为4NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA | |
| D. | 标准状况下,16g甲烷分子所含质子数为10NA |
9.生活离不开化学,下列说法正确的是( )
| A. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| B. | 乙醇和汽油都是可再生资源,应大力推广使用“乙醇汽油” | |
| C. | 加入明矾使海水中的盐分沉淀可以使海水淡化,解决“淡水供应危机” | |
| D. | 要尽快发现地球上的有用物质,加大开采速度,加快社会发展 |
13.下列离子方程式的书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2 O | |
| C. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| D. | 纯碱溶液中通入二氧化碳:CO32-+CO2+H2O=2HCO3- |
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是: