题目内容
14.A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,B原子的最外层电子数是电子层数的3倍,C、D两原子的最外层电子数分别是内层电子总数的一半.C元素是植物生长的营养元素之一,试写出:(1)A、B元素形成的A元素最高价化合物的化学式N2O5;
(2)D元素的单质与水反应的化学方程式2Li+2H2O=2LiOH+H2↑;
(3)A、C元素气态氢化物的稳定性大小PH3<NH3.(用化学式表示).
分析 有A、B、C、D四种短周期元素,A元素的最高价氧化物的水化物与其氢化物反应得到离子化合物,则A是N元素;B原子的最外层电子数是电子层数的3倍,为O元素,C和D两原子的最外层电子数分别是内层电子数的一半,C元素是植物生长的营养元素之一,则C是P元素,D是Li元素,
(1)A、B元素形成的最高价氧化物是五氧化二氮;
(2)Li和水反应生成LiOH和氢气;
(3)元素的非金属性越强,其气态氢化物的稳定性越强.
解答 解:有A、B、C、D四种短周期元素,A元素的最高价氧化物的水化物与其氢化物反应得到离子化合物,则A是N元素;B原子的最外层电子数是电子层数的3倍,为O元素,C和D两原子的最外层电子数分别是内层电子数的一半,C元素是植物生长的营养元素之一,则C是P元素,D是Li元素,
(1)A、B元素形成的最高价氧化物是五氧化二氮,化学式为N2O5,故答案为:N2O5;
(2)Li和水反应生成LiOH和氢气,反应方程式为2Li+2H2O=2LiOH+H2↑,故答案为:2Li+2H2O=2LiOH+H2↑;
(3)元素的非金属性越强,其气态氢化物的稳定性越强,非金属性N>P,所以A和C元素气态氢化物的稳定性:PH3<NH3,故答案为:PH3;NH3.
点评 本题考查位置结构性质相互关系及应用,涉及元素推断、元素周期律应用、物质性质等知识点,熟练掌握元素周期律并灵活运用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.综合如图判断,下列正确的说法是( )
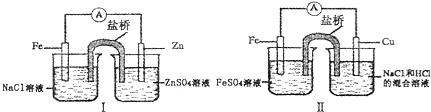

| A. | 装置I和装置II中负极反应均是Fe-2e-═Fe2+ | |
| B. | 装置I和装置II中正极反应均是O2+4e-+2H2O-═4OH- | |
| C. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| D. | 装置I和装置II中正极均被保护 |
9.下列反应中会有沉淀产生的是( )
| A. | 将二氧化硫气体通入酸性KMnO4溶液中 | |
| B. | 将二氧化硫气体通入碘水中 | |
| C. | 将二氧化硫气体通入BaCl2溶液中 | |
| D. | 将少量二氧化硫气体通入Ba(OH)2溶液中 |
12.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是( )
| A. | 氢化物的稳定性甲>乙>丙 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:丙<甲 | |
| C. | 原子半径由大到小的顺序为:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
9.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氯化氢的电子式: | D. | S2-的结构示意图: |
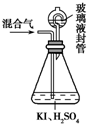 用如图装置可以测定混合气中ClO2的含量:
用如图装置可以测定混合气中ClO2的含量:
 .
. .
. .
. .
.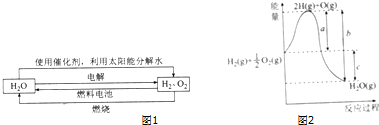 科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.
科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.