题目内容
14.阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的右边托盘上放置M+4Q g砝码.分析 同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为$\frac{30+2}{2}$=16,而SO2的相对分子质量为64,则相同体积SO2的与NO和H2的混合气体的质量为4:1,据此解答.
解答 解:同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为$\frac{30+2}{2}$=16,而SO2的相对分子质量为64,称量物品质量时,砝码应放在天平的右盘,设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=$\frac{Q}{16}$,当充满SO2气体时,气体的质量为:m=64n=64×$\frac{Q}{16}$=4Q,容器的总质量为M+4Q,
故答案为:右;M+4Q.
点评 本题考查阿伏伽德罗定律及其推论,根据PV=nRT理解阿伏伽德罗定律及其推论进行计算即可解答,题目难度中等.

练习册系列答案
相关题目
16.1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广泛、高效、无刺激、无腐蚀等特点,对防治禽流感、口蹄疫、猪瘟等有良好效果.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 |
5.汽车尾气在光照下,发生光化学烟雾的循环,它的形成过程可用下面的化学方程式表示:NO2$\frac{\underline{\;光\;}}{\;}$NO+O,2NO+O2═2NO2,O+O2═O3.下列叙述中不正确的是( )
| A. | 在此过程中,NO2是氧化剂 | |
| B. | 在此过程中,NO是反应的中间产物 | |
| C. | 该过程总反应的化学方程式为2O3═3O2 | |
| D. | 光化学烟雾能引起人严重的呼吸功能障碍 |
2.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A. | 第14列元素的最高价氧化物的化学式为RO2 | |
| B. | 第2列元素中一定没有非金属元素 | |
| C. | 在18列元素中,第3列元素种类最多 | |
| D. | 第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
6.相同温度下,将等体、积等pH的醋酸和盐酸溶液,分别加入V1 mL、V2mL的水稀释后,测得溶液的pH仍然相同,则下列关系正确的是( )
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | 无法判断 |
3.物质的量相同的下列有机物,充分燃烧耗氧量最大的是( )
| A. | C2H2 | B. | C2H6 | C. | C4H6 | D. | C4H8 |
 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②经查阅资料得知:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH.
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②经查阅资料得知:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH.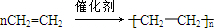

 C6H14
C6H14  C5H10.
C5H10. 用如图装置可以测定混合气中ClO2的含量:
用如图装置可以测定混合气中ClO2的含量: