题目内容
16.依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.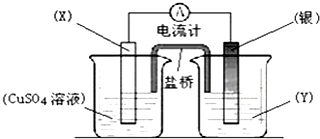
请回答下列问题:
(1)用化学符号回答:电极X的材料是Cu;电解质溶液Y是AgNO3溶液;
(2)银电极发生的电极反应为2Ag++2e-=2Ag;X电极上发生的电极反应为Cu-2e-=Cu2+;
(3)当外电路有0.2mol的电子通过时,X电极的质量变化6.4 克.
分析 根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为2Ag++2e-=2Ag,电解质溶液为AgNO3 ,根据电极反应式做计算,由此分析解答.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为2Ag++2e-=2Ag,Cu失电子被氧化,为原电池负极,电极反应为Cu-2e-=Cu2+,
故答案为:2Ag++2e-=2Ag;Cu-2e-=Cu2+;
(3)X电极反应为Cu-2e-=Cu2+,当外电路有0.2mol的电子通过时,有0.1mol铜溶解,故质量变化为6.4g,
故答案为:6.4.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
6.相同温度下,将等体、积等pH的醋酸和盐酸溶液,分别加入V1 mL、V2mL的水稀释后,测得溶液的pH仍然相同,则下列关系正确的是( )
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | 无法判断 |
7.下列反应是吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰.
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰.
| A. | ①②④ | B. | ②③ | C. | ①④⑤ | D. | ②④ |
11. 某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
 某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )| A. | 铜片上的电极反应:Cu2++2e-═Cu | |
| B. | 电池工作时电能直接转化为化学能 | |
| C. | 外电路中电子由铜片经导线流向锌片 | |
| D. | 铜片为电池的正极 |
8.根据所学知识,你认为下列叙述正确的是( )
| A. | 同周期元素原子的最外层电子数相同 | |
| B. | 在周期表中,最外层电子数为1的元素都是金属元素 | |
| C. | 在周期表中,第18列元素的化学性质很稳定 | |
| D. | ⅦA族元素容易失去电子 |
5.综合如图判断,下列正确的说法是( )


| A. | 装置I和装置II中负极反应均是Fe-2e-═Fe2+ | |
| B. | 装置I和装置II中正极反应均是O2+4e-+2H2O-═4OH- | |
| C. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| D. | 装置I和装置II中正极均被保护 |
12.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是( )
| A. | 氢化物的稳定性甲>乙>丙 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:丙<甲 | |
| C. | 原子半径由大到小的顺序为:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
 用如图装置可以测定混合气中ClO2的含量:
用如图装置可以测定混合气中ClO2的含量: