题目内容
7.氮及氮的化合物有着重要的用途.(1)氮元素在周期表中的位置是第2周期VA族;NH3的电子式是
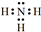 .
.(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO(用化学方程式表示).
(3)工业合成氨是人工固氮的重要方法.2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图1:
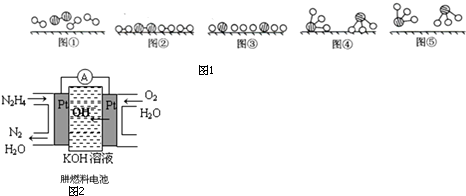
下列说法正确的是bc(选填字母).
a.图①表示N2、H2分子中均是单键
b.图②→图③需要吸收能量
c.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266kJ/mol.
(5)用氨气作原料可制备重要燃料--肼(N2H4).
①通常在催化剂存在下,用次氯酸钠与氨反应可制备肼.该反应的化学方程式是2NH3+NaClO═N2H4+NaCl+H2O.
②如图为肼燃料电池示意图,其负极的电极反应式是N2H4-4e-+4OH-=N2+4H2O.
分析 (1)氮元素原子序数为7,两个电子层最外层5个电子,根据共价化合物电子式的书写规则书写;
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,如氮气和氢气合成氨、氮气和氧气放电反应生成一氧化氮;
(3)a.氮气分子中是三键;
b.图②是表示N2、H2被吸附在催化剂的表面;图③则表示在催化剂表面,N2、H2中的化学键断裂;
c.在化学变化中,氮分子和氢分子在催化剂的作用下分解成氢原子和氮原子,然后原子又重新组合成新的分子;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(5)①用次氯酸钠与氨反应可制备肼发生氧化还原反应;
②作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2.
解答 解:(1)氮元素在周期表中的位置是第二周期,ⅤA族,A氨气是共价化合物,各原子间通过共用电子对形成共价键,所以其电子式为: ,
,
故答案为:第2周期VA族,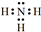 ;
;
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,如氮气和氢气合成氨、氮气和氧气放电反应生成一氧化氮,反应的化学方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(3)a.图①表示N2、H2分子中不都是单键,氮气是三键,故a错误;
b.分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,图②→图③需要吸收能量,故b正确;
c.在化学变化中,氮分子和氢分子在催化剂的作用下分解成氢原子和氮原子,然后原子又重新组合成新的分子,该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成,故c正确;
故答案为:bc;
(4)①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
依据盖斯定律计算②×3-①×2得到氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266 kJ/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266 kJ/mol;
(5)①用次氯酸钠与氨反应可制备肼发生氧化还原反应,反应的化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O,
故答案为:2NH3+NaClO═N2H4+NaCl+H2O;
②肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,
故答案为:N2H4-4e-+4OH-=N2+4H2O.
点评 本题考查了微粒结构、化学反应实质的理解应用、热化学方程式书写、原电池原理的理解应用,题目难度中等.

| A. | 蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
| A. | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
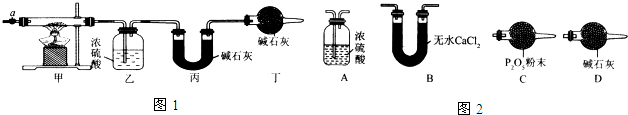
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如表数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2 的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
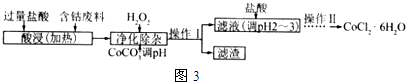
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取 CoCl2•6H2O的一种工艺如图3:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3、Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能含有CuS | |
| D. | 探究向滴有酚酞的NaOH溶液中通入Cl2,溶液红色褪去的原因是溶液酸碱性改变所致,还是HClO的漂白性所致 |
| A. | NO | B. | N2O3 | C. | NO2 | D. | N2O4 |
 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: