题目内容
16.氮有多种化合价,其常见氧化物有NO、N2O3、NO2、N2O4,其含氧酸有HNO2、HNO3,属于酸性氧化物的是( )| A. | NO | B. | N2O3 | C. | NO2 | D. | N2O4 |
分析 氧化物是由两种元素组成并且一种元素是氧元素的化合物,能和碱反应生成盐和水的氧化物属于酸性氧化物,且反应中中心原子化合价不变.
解答 解:A.NO属于氧化物,但NO与碱不反应,不属于酸性氧化物,故A不选;
B.N2O3是HNO2的酸酐,所以2NaOH+N2O3=2NaNO2+H2O,N2O3属于酸性氧化物,故B选;
C.NO2属于氧化物,但NO2与碱发生氧化还原反应如2NO2+2NaOH═NaNO2+NaNO3+H2O,不是酸性氧化物,故C不选;
D.N2O4属于氧化物,与碱发生氧化还原反应如N2O4+2NaOH═NaNO2+NaNO3+H2O,不是酸性氧化物,故D不选;
故选B.
点评 本题主要考查氧化物的概念,解答时要分析物质的元素组成,然后再根据氧化物概念的含义进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
6.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐在低温碱性环境中稳定,易溶于水,难溶于无水乙醇等有机溶剂.
常见高铁酸钾的制备方法如下:
(1)干法制备反应中氧化剂和还原剂的物质的量之比为:3:1.
(2)某湿法制备高铁酸钾的基本流程及步骤如下:
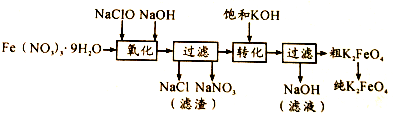
①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
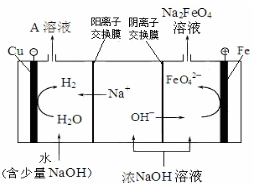
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是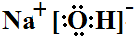 .
.
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38、Ksp[Cu(OH)2]=2.2×10-20,向该温度下含有Fe3+、Cu2+浓度均为0.01mol/L的溶液中,滴加浓NaOH溶液,当溶液pH=10时,溶液中c(Cu2+):c(Fe3+)=5.5×1013:1.
常见高铁酸钾的制备方法如下:
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
(2)某湿法制备高铁酸钾的基本流程及步骤如下:

①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是
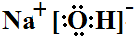 .
.
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38、Ksp[Cu(OH)2]=2.2×10-20,向该温度下含有Fe3+、Cu2+浓度均为0.01mol/L的溶液中,滴加浓NaOH溶液,当溶液pH=10时,溶液中c(Cu2+):c(Fe3+)=5.5×1013:1.
11.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示,下列叙述不正确的是( )

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
1.将溴水和苯混合振荡,静置后分液分离,把分离出的苯置于一试管中,加入某些物质后可以在试管口产生白雾,这种物质是( )
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
8.生活中处处有化学,下列有关说法正确的是( )
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 | |
| C. | 地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候 | |
| D. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
4.为探究外界条件对H2 (g)+I2 (g)═2HI (g)△H>0 反应速率的影响,设计下表所示实验:
(1)完成上表中的空格.①探究温度对该反应速率的影响②0③457
(2)实验Ⅰ中,I2的物质的量浓度(c)随时间(t)的变化如图所示.
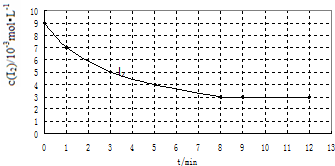
根据图中数据回答下列问题:
①在0~5min内反应的平均速率v(I2)=1×10-3mol•L-1•min-1.
②该温度下,反应的平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})×c({I}_{2})}$=48.(前空写表达式,后空写计算所得的数据)
③该同学还想用此反应研究压强对化学平衡移动的影响,请问能否达到实验目的?请说明原因.
不能(填“能”、不能”),原因是该反应前后气体计量数相等,平衡不受压强的影响.
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | ① | 420 | ② | 7 | 9 |
| Ⅲ | 探究催化剂对该反应速率的影响 | ③ | 10 | 7 | 9 |
(2)实验Ⅰ中,I2的物质的量浓度(c)随时间(t)的变化如图所示.

根据图中数据回答下列问题:
①在0~5min内反应的平均速率v(I2)=1×10-3mol•L-1•min-1.
②该温度下,反应的平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})×c({I}_{2})}$=48.(前空写表达式,后空写计算所得的数据)
③该同学还想用此反应研究压强对化学平衡移动的影响,请问能否达到实验目的?请说明原因.
不能(填“能”、不能”),原因是该反应前后气体计量数相等,平衡不受压强的影响.
5.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、PH3、H2S稳定性依次减弱 | |
| C. | NaOH、KOH、Ca(OH)2碱性依次减弱 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次减小 |
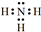 .
.
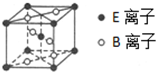 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题: