题目内容
下列叙述不正确的是( )
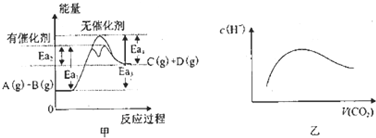

| A、由甲可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H═+(Ea3-Ea4)KJ?mol-1 | ||||
B、常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图乙变化关系;当
| ||||
| C、己知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为2×10-4mol/L | ||||
| D、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混台后(不考虑混台后溶液体积的变化)恰好完全反应,反应后的溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1 |
考点:反应热和焓变,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质,离子浓度大小的比较
专题:基本概念与基本理论
分析:A、△H=反应物的活化能-生成物的活化能;
B、过量二氧化碳通入NaOH溶液中反应过程中,溶液由碱性逐渐变为弱酸性,对水电离的抑制程度先减小,后增大;当
<
<l时,分析溶液中的溶质为Na2CO3与NaHCO3,根据物料守恒判断;
C、据Ksp(CaCO3)=c(Ca2+)?c(CO32-)计算;
D、恰好完全反应,则溶液中的溶质为NH4Cl,据物料守恒解答.
B、过量二氧化碳通入NaOH溶液中反应过程中,溶液由碱性逐渐变为弱酸性,对水电离的抑制程度先减小,后增大;当
| 1 |
| 2 |
| a |
| b |
C、据Ksp(CaCO3)=c(Ca2+)?c(CO32-)计算;
D、恰好完全反应,则溶液中的溶质为NH4Cl,据物料守恒解答.
解答:
解:A、有催化剂存在的反应中,△H=反应物的活化能-生成物的活化能=+(Ea3-Ea4)KJ?mol-1,故A正确;
B、过量二氧化碳通入NaOH溶液中反应过程中,溶液由碱性逐渐变为弱酸性,对水电离的抑制程度先减小,后增大,所以,水电离出来的氢离子浓度先增大,后减小,符合图乙;当
<
<l时,溶液中的溶质为Na2CO3与NaHCO3,据物料守恒1<c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]<2,故B错误;
C、Ksp(CaCO3)=c(Ca2+)?c(CO32-),若CaBr2溶液的浓度为5.6×10-5mol/L,则有:5.6×10-5mol/L×c(CO32-)=2.8×10-9,c(CO32-)=2×10-4mol/L,故C正确;
D、氨水与盐酸等体积混合,恰好完全反应,则溶液中的溶质为NH4Cl,若不考虑铵根的水解等,则c(NH4+)=c(Cl-)=0.05mol/L,铵根水解,水解产物可能少部分分解,N原子在溶液中有3种存在形式NH4+、NH3?H2O与NH3,所以,溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1,故D正确.
故选:B.
B、过量二氧化碳通入NaOH溶液中反应过程中,溶液由碱性逐渐变为弱酸性,对水电离的抑制程度先减小,后增大,所以,水电离出来的氢离子浓度先增大,后减小,符合图乙;当
| 1 |
| 2 |
| a |
| b |
C、Ksp(CaCO3)=c(Ca2+)?c(CO32-),若CaBr2溶液的浓度为5.6×10-5mol/L,则有:5.6×10-5mol/L×c(CO32-)=2.8×10-9,c(CO32-)=2×10-4mol/L,故C正确;
D、氨水与盐酸等体积混合,恰好完全反应,则溶液中的溶质为NH4Cl,若不考虑铵根的水解等,则c(NH4+)=c(Cl-)=0.05mol/L,铵根水解,水解产物可能少部分分解,N原子在溶液中有3种存在形式NH4+、NH3?H2O与NH3,所以,溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1,故D正确.
故选:B.
点评:本题考查活化能对焓变的影响、二氧化碳与NaOH溶液反应的产物及对水电离的影响、Ksp的计算以及溶液中的物料守恒等等,题目考查范围较广,有一定难度.

练习册系列答案
相关题目
某同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列感悟,其中不正确的是( )
| A、离子化合物中可能含共价键 |
| B、共价化合物中一定不含离子键 |
| C、所有物质中都含有化学键 |
| D、离子化合物中不一定含金属元素 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温常压下,9gH2O含有分子数为0.5NA |
| B、标准状况下,以任意比例混合的甲烷和丙烷(C3H8)的气体混合物11.2L,则所含有的分子数为NA |
| C、常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA |
| D、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
下列说法正确的是( )
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、淀粉和蛋白质均可作为生产葡萄糖的原料 |
| C、石油裂化和油脂皂化都是高分子生成小分子的过程 |
| D、装饰材料中的甲醛和芳香烃会造成居室污染 |
可逆反应2NO2?O2+2NO在密闭容器中反应,达到平衡状态的标志是( )
| A、NO2、NO和O2 三者共存 |
| B、单位时间内生成2mol NO同时消耗2mol NO2 |
| C、v(NO2)正=2v(O2)逆 |
| D、容器中的各物质物质的量浓度之比为2:2:1的状态 |
已知一定条件下断裂或生成某些化学键的能量关系如下表:
请用此数据估计,由Cl2、H2生成1mol HCl时的热效应( )
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、放热183kJ |
| B、放热91.5kJ |
| C、吸热183kJ |
| D、吸热91.5kJ |
下列叙述正确的是( )
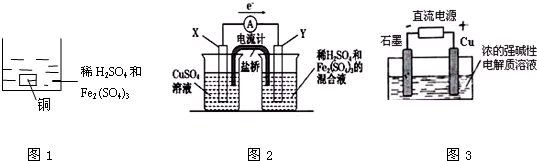

| A、如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L |
| B、如图2所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜 |
| C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 |
| D、如图3所示,当有0.1mol电子转移时,有0.1mol Cu2O生成 |
化学与生活、生产、社会关系密切,下列叙述正确的是( )
| A、目前治理白色污染的方法主要是减少使用、加强回收 |
| B、少量钠、钾要在干燥的试剂瓶中保存妥善保管 |
| C、废旧电池应集中回收进行填埋处理 |
| D、柠檬是酸性食物 |