题目内容
室温下,下列的实验现象及其解释对应正确的是( )
| 选项 | 实验及现象 | 理论解释 |
| A | 向等体积等浓度的Na2CO3和NaHCO3溶液中分别滴加酚酞溶液,前者溶液红色更深 | Na2CO3比NaHCO3的溶解度大 |
| B | 向等体积混合的AgCl与AgI的饱和溶液中滴加足量浓AgNO3溶液,生成沉淀AgI多于AgCl | AgI比AgCl的溶解度更小,更容易沉淀 |
| C | 将绿豆粒大小的钠加入到乙醇中,钠在液面上剧烈反应 | 钠的密度小于乙醇,钠能置换出醇羟基中的氢,生成了氢气 |
| D | 向盛有经打磨的铝片的试管中加入5mL 6mol?L-1盐酸,气泡生成速率先加快后减慢 | 反应放热致温度升高是速率先加快的主要原因;c(H+)降低是速度后减慢的主要原因 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.Na2CO3水解程度大;
B.AgCl与AgI的饱和溶液中,均存在溶解平衡,加入足量浓AgNO3溶液,AgCl与AgI的溶解平衡向左移动,但AgI的溶解度更小,溶液中AgCl沉淀较多;
C.钠加入到乙醇中,沉到液面下;
D.气泡生成速率先加快后减慢,加快与温度有关,后来减慢,与离子浓度有关.
B.AgCl与AgI的饱和溶液中,均存在溶解平衡,加入足量浓AgNO3溶液,AgCl与AgI的溶解平衡向左移动,但AgI的溶解度更小,溶液中AgCl沉淀较多;
C.钠加入到乙醇中,沉到液面下;
D.气泡生成速率先加快后减慢,加快与温度有关,后来减慢,与离子浓度有关.
解答:
解:A.向等体积等浓度的Na2CO3和NaHCO3溶液中分别滴加酚酞溶液,前者溶液红色更深,是因Na2CO3水解程度大,碱性强,与溶解度无关,故A错误;
B.在AgCl和AgI两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(I-),当将AgCl、AgI两饱和溶液混合时,由于Ksp(AgCl)>Ksp(AgI),发生沉淀转化,生成更多的AgI沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgI沉淀有所增多,但AgCl沉淀增加更多,即生成的沉淀AgCl多,故B错误;
C.钠的密度大于乙醇,则将绿豆粒大小的钠加入到乙醇中,钠在液面下,且反应较平稳,故C错误;
D.向盛有经打磨的铝片的试管中加入5mL 6mol?L-1盐酸,为放热反应,温度升高是速率先加快,后来c(H+)降低,则速度减慢,故D正确;
故选D.
B.在AgCl和AgI两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(I-),当将AgCl、AgI两饱和溶液混合时,由于Ksp(AgCl)>Ksp(AgI),发生沉淀转化,生成更多的AgI沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgI沉淀有所增多,但AgCl沉淀增加更多,即生成的沉淀AgCl多,故B错误;
C.钠的密度大于乙醇,则将绿豆粒大小的钠加入到乙醇中,钠在液面下,且反应较平稳,故C错误;
D.向盛有经打磨的铝片的试管中加入5mL 6mol?L-1盐酸,为放热反应,温度升高是速率先加快,后来c(H+)降低,则速度减慢,故D正确;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及盐类水解、沉淀生成、乙醇的性质及影响反应速率的因素等,侧重化学反应原理及实验分析能力的考查,注意实验的评价性、操作性分析,选项B为解答的易错点,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列物质中各含有少量杂质,能用饱和Na2CO3溶液并借助于分液漏斗除去杂质的是( )
| A、苯中含有少量甲苯 |
| B、乙醇中含少量乙酸 |
| C、乙酸乙酯中含有少量乙酸 |
| D、溴苯中含有少量苯 |
下列措施中,能加快化学反应速率的是( )
| A、将食物储存在冰箱里 |
| B、用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 |
| C、往H2O2溶液中加入少量MnO2 |
| D、用纯锌代替粗锌与1mol/L H2SO4溶液反应 |
下列叙述不正确的是( )
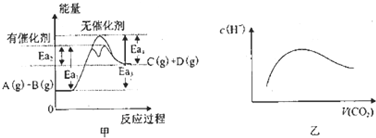

| A、由甲可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H═+(Ea3-Ea4)KJ?mol-1 | ||||
B、常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图乙变化关系;当
| ||||
| C、己知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为2×10-4mol/L | ||||
| D、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混台后(不考虑混台后溶液体积的变化)恰好完全反应,反应后的溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1 |
下列溶液中,不能鉴别SO2与CO2气体的是( )
①KMnO4溶液;②H2S;③澄清石灰水;④酸化Ba(NO3)2;⑤FeCl3和BaCl2混合溶液;⑥品红溶液;⑦Na2SiO3溶液;⑧BaCl2溶液.
①KMnO4溶液;②H2S;③澄清石灰水;④酸化Ba(NO3)2;⑤FeCl3和BaCl2混合溶液;⑥品红溶液;⑦Na2SiO3溶液;⑧BaCl2溶液.
| A、③⑦⑧ | B、①②③ |
| C、③④⑤⑦ | D、④⑤⑥⑦ |
下列关于煤、石油、天然气等资源的说法正确的是( )
| A、石油裂解得到的汽油可用于作溴水中进取溴的萃取剂 |
| B、可利用干馏的方法将煤中的苯和苯酚等分离 |
| C、石油分馏产品可在催化剂作用下,通过裂化反应,从而提高汽油的产量和质量 |
| D、水煤气是通过煤的液化得到的气体燃料 |
将11.2gFe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到40g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在密闭容器中高温加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为( )
| A、2240mL |
| B、4480mL |
| C、3360mL |
| D、1120mL |
关于元素周期表,以下说法错误的是( )
| A、计算机芯片的组成元素位于第14列 |
| B、元素周期表共有7个周期,16个族 |
| C、每一周期的元素都是从碱金属开始,最后以稀有气体结束 |
| D、第二、三周期中,同一列上下相邻元素的原子核外电子数相差8个 |
下列反应前后物质的总能量变化可用如图表示的是( )


| A、生石灰加水生成熟石灰 |
| B、C+H2O═CO+H2 |
| C、金属钠与水反应 |
| D、HNO3+NaOH═NaNO3+H2O |