题目内容
某同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列感悟,其中不正确的是( )
| A、离子化合物中可能含共价键 |
| B、共价化合物中一定不含离子键 |
| C、所有物质中都含有化学键 |
| D、离子化合物中不一定含金属元素 |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:A.离子化合物中可能含有共价键,但共价化合物中一定不含离子键;
B.共价化合物中一定不含离子键,只含共价键;
C.不是所有物质中都存在化学键,单原子分子中不存在化学键;
D.离子化合物中不一定含有金属元素,可能全部由非金属元素组成.
B.共价化合物中一定不含离子键,只含共价键;
C.不是所有物质中都存在化学键,单原子分子中不存在化学键;
D.离子化合物中不一定含有金属元素,可能全部由非金属元素组成.
解答:
解:A.离子化合物中可能含有共价键,但共价化合物中一定不含离子键,如KOH,故A正确;
B.只含共价键的化合物是共价化合物,所以共价化合物中一定不含离子键,故B正确;
C.不是所有物质中都存在化学键,单原子分子中不存在化学键,如稀有气体,故C错误;
D.离子化合物中不一定含有金属元素,可能全部由非金属元素组成,如铵盐,故D正确;
故选C.
B.只含共价键的化合物是共价化合物,所以共价化合物中一定不含离子键,故B正确;
C.不是所有物质中都存在化学键,单原子分子中不存在化学键,如稀有气体,故C错误;
D.离子化合物中不一定含有金属元素,可能全部由非金属元素组成,如铵盐,故D正确;
故选C.
点评:本题考查了物质和化学键的关系,根据物质的构成微粒及微粒间的作用力来分析解答,易错选项是CD,注意稀有气体分子的特点,含有金属元素的化合物不一定是离子化合物,如氯化铝,这些都是易错点.

练习册系列答案
相关题目
下列说法正确的是( )


| A、图I所示装置用于Cu和浓H2SO4制取少量的SO2气体 |
| B、图Ⅱ装置可验证非金属性:Cl>C>Si |
| C、图Ⅲ可用于收集气体H2、CO2、Cl2、NH3 |
| D、图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化 |
关于如图所示装置的叙述,正确的是( )


| A、铜片上发生氧化反应 |
| B、铜片质量逐渐减少 |
| C、氢离子在铜片表面被还原 |
| D、电流从锌片经导线流向铜片 |
鉴别二甲醚和乙醇可采用化学方法或物理方法,下列方法不能对二者进行鉴别的是( )
| A、利用金属钠或金属钾法 |
| B、利用红外光谱法 |
| C、利用质谱法 |
| D、利用核磁共振氢谱法 |
下列物质中各含有少量杂质,能用饱和Na2CO3溶液并借助于分液漏斗除去杂质的是( )
| A、苯中含有少量甲苯 |
| B、乙醇中含少量乙酸 |
| C、乙酸乙酯中含有少量乙酸 |
| D、溴苯中含有少量苯 |
丙烯酸(CH3COOCH2-CH=CH-COOH)的性质可能有( )①加成反应 ②水解反应 ③酯化反应 ④中和反应 ⑤氧化反应 ⑥取代反应.
| A、只有①③ |
| B、只有①③④ |
| C、只有①③④⑤ |
| D、①②③④⑤⑥ |
下列叙述不正确的是( )
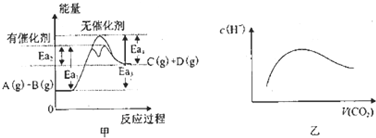

| A、由甲可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H═+(Ea3-Ea4)KJ?mol-1 | ||||
B、常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图乙变化关系;当
| ||||
| C、己知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为2×10-4mol/L | ||||
| D、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混台后(不考虑混台后溶液体积的变化)恰好完全反应,反应后的溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1 |
