题目内容
已知一定条件下断裂或生成某些化学键的能量关系如下表:
请用此数据估计,由Cl2、H2生成1mol HCl时的热效应( )
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、放热183kJ |
| B、放热91.5kJ |
| C、吸热183kJ |
| D、吸热91.5kJ |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:据△H=反应物的键能和-生成物的键能和解答.
解答:
解:Cl2+H2=2HCl,△H=反应物的键能和-生成物的键能和=243KJ/mmol+436KJ/mol-2×431KJ/mol=-183KJ/mol,△H<0反应放热,生成1molHCl时放热91.5KJ,
故选:B.
故选:B.
点评:本题考查反应热与化学键的关系,要正确利用利用△H=反应物的键能和-生成物的键能和,注意△H与化学计量数的对应.

练习册系列答案
相关题目
下列物质中,只含共价键的是( )
| A、KCl |
| B、H2O2 |
| C、NaOH |
| D、CaCl2 |
下列叙述不正确的是( )
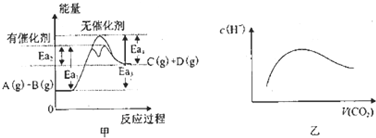

| A、由甲可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H═+(Ea3-Ea4)KJ?mol-1 | ||||
B、常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图乙变化关系;当
| ||||
| C、己知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为2×10-4mol/L | ||||
| D、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混台后(不考虑混台后溶液体积的变化)恰好完全反应,反应后的溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1 |
一定温度下,可逆反应H2(g)+I2(g)?2HI(g)达到限度的标志是( )
| A、H2,I2,HI三种物质的浓度一定相等 |
| B、H2,I2全部反应生成了HI |
| C、H2,I2,HI三种物质的浓度保持不变 |
| D、反应中正反应速率逐渐减小,最后减小为零 |
下列关于煤、石油、天然气等资源的说法正确的是( )
| A、石油裂解得到的汽油可用于作溴水中进取溴的萃取剂 |
| B、可利用干馏的方法将煤中的苯和苯酚等分离 |
| C、石油分馏产品可在催化剂作用下,通过裂化反应,从而提高汽油的产量和质量 |
| D、水煤气是通过煤的液化得到的气体燃料 |
下列判断错误的是( )
| A、稳定性:H2O>H2S>H2Se |
| B、半径:Na+>Mg2+>F- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
取质量均为6.5g的两份锌粉a和b,分别加入100mL 2mol/L的稀硫酸中,并向a中加入少量CuSO4溶液,下列说法正确的是( )
| A、a比b 生成氢气的速率快,生成氢气的总量相同 |
| B、b比a 生成氢气的速率快,生成氢气的总量相同 |
| C、a比b 生成氢气的速率快,生成氢气的总量a比b多 |
| D、a比b 生成氢气的速率快,生成氢气的总量a比b少 |



