题目内容
15.日常生活和工业生产中常用到漂白剂.下列物质没有漂白作用的是( )| A. | H2O2 | B. | 新制氯水 | C. | CaCl2 | D. | SO2 |
分析 具有强氧化性的物质能使有色物质褪色,如HClO等,而SO2与有色物质化合生成无色物质,使有色物质褪色,以此来解答.
解答 解:A.过氧化氢具有强氧化性,具有漂白性,故A不选;
B.新制氯水中含有次氯酸,次氯酸具有强氧化性,具有漂白性,故B不选;
C.氯化钙不具有漂白性,故C选;
D.二氧化硫能够与有色物质化合,具有漂白性,故D不选;
故选:C.
点评 本题考查漂白性,注意二氧化硫的漂白原理是利用化合反应生成无色物质,属于暂时性的漂白,注意归纳常见的漂白性物质及漂白原理,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
5.相对分子质量均为88的饱和一元醇和饱和一元羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)( )
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 32种 |
10.下列表示物质结构的化学用语正确的是( )
| A. | 乙酸的结构简式:CH3COOH | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | Cl-的结构示意图: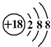 | D. | 乙烯的结构简式CH2CH2 |
7.图中曲线表示短周期元素的原子序数(技递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是( )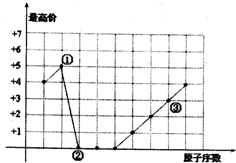

| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
4. 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
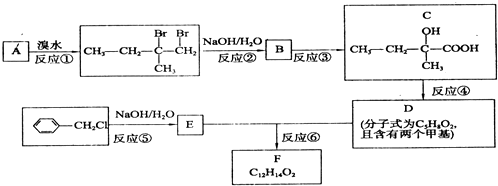
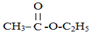 相关物质间转化关系如图:
相关物质间转化关系如图: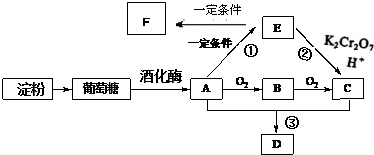
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$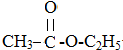 +H2O
+H2O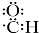

 .
. .
. .
.
 .
. 铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题:
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题: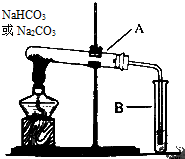 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.