题目内容
12. 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.(1)Fe基态原子价电子排布式为3d64s2.
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为CO2、N2O、CS2、COS (填化学式).
(3)蛋白质分子中氨基氮原子的轨道杂化类型是sp3; 1mol 乙酸分子中含有σ的键的数目为7mol或7×6.02×1023或7NA.
(4)把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),写出该变化的化学方程式2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl.
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为6,若该晶胞边长为acm,则该晶体密度为$\frac{288}{{a}^{3}{N}_{A}}$g/cm3.
分析 (1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,根据构造原理书写Fe核外价电子排布式;
(2)原子个数相等且价电子数相等的分子或离子为等电子体;
(3)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;乙酸分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键;
(4)氯气将+2价的铁氧化成+3价的铁,根据电子得失守恒书写化学方程式;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,从而确定亚铁离子配位数;该晶胞密度=$\frac{m}{V}$.
解答 解:(1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,根据构造原理书写Fe核外价电子排布式为3d64s2,故答案为:3d64s2;
(2)SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为CO2、N2O、CS2、COS等,故答案为:CO2、N2O、CS2、COS;
(3)氮原子含有3个共价键和一个孤电子对,N原子轨道的杂化类型是sp3,乙酸分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键,所以1mol乙酸分子中含有的σ键的数目为7 mol或7×6.02×1023或7NA,
故答案为:sp3;7 mol或7×6.02×1023或7NA;
(4)氯气将+2价的铁氧化成+3价的铁,所以反应方程式为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl,故答案为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,结合图片知,亚铁离子配位数为6,
该晶胞中亚铁离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O离子个数=12×$\frac{1}{4}$+1=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{72}{{N}_{A}}×4}{{a}^{3}}$g/cm3=$\frac{288}{{a}^{3}{N}_{A}}$g/cm3,故答案为:6;$\frac{288}{{a}^{3}{N}_{A}}$g/cm3.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体、原子核外电子排布等知识点,侧重考查学生分析计算能力,难点是晶胞及配位数的计算,题目难度中等.


下列说法正确的是( )
| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
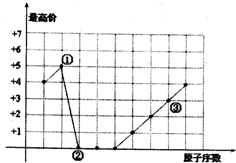
| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
| A. | 蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

(提示:苯甲酸甲酯粗产品往往含有少量甲醇、硫酸、苯甲酸和水等)
(1)简述第一步混合液体时,最后加入浓硫酸的理由是浓硫酸密度较大,且易于苯甲酸、甲醇混合放出大量热量,甲醇易挥发.若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
 .
.(2)反应物CH3OH应过量,理由是该反应是可逆反应,增加甲醇的量,使平衡向右移动,有利于提高苯甲酸的转化率.
(3)分液时上层液体从分液漏斗的上口出来,接受馏分时温度控制在199.6℃左右.
(4)以上流程图中加入Na2CO3的作用是通过反应消耗硫酸、苯甲酸,降低苯甲酸甲酯的溶解度.
(5)通过计算,苯甲酸甲酯的产率为65%.
 .
. 铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题:
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题: 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: