题目内容
17.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe有关该电池的下列中,正确的是( )| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
分析 Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:Li-e-═Li+,又知该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,所以电池反应为:2Li+FeS═Li2S+Fe,充电时为电解池原理,阴极发生还原反应,反应式是2Li++2e-═2Li.
解答 解:A、Li和Al都属于金属,在电池中作为负极材料,所以Li-Al应该属于合金而不是化合物,因此化合价为0价,故A错误;
B、Li和水反应生成LiOH和氢气,所以电解质溶液不能是电解质的水溶液,故B错误;
C、根据正极反应2Li++FeS+2e-═Li2S+Fe与负极反应2Li-2e-═2Li+相加可得反应的电池反应式为:2Li+FeS═Li2S+Fe,故C正确;
D、充电时为电解池原理,阴极发生还原反应,正确的反应式是2Li++2e-═2Li,故D错误.
故选C.
点评 本题涵盖电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
相关题目
7.已知2SO2(g)+O2(g)?2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%.若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
| A. | 10mol 10% | B. | 20mol 20% | C. | 20mol 40% | D. | 30mol 80% |
8.下列实验操作、现象和结论有不正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入含紫色石蕊试液的水中 | 溶液先变红后褪色 | SO2有漂白性 |
| B | 将纯Fe(NO3)2样品溶于稀H2SO4中,滴加KSCN溶液 | 溶液变红 | HNO3氧化性强于Fe3+的氧化性 |
| C | 将新制氯水和KI溶液在试管中混合后,加入CCl4,振荡静置 | 溶液分层,下层呈紫色 | 非金属性:Cl>I |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
5.相对分子质量均为88的饱和一元醇和饱和一元羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)( )
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 32种 |
2.某兴趣小组进行铁矿石中含铁量的测定,实验过程如图:

下列说法正确的是( )

下列说法正确的是( )
| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
9.下列物质中既有离子键又有共价键的是 ( )
| A. | MgO | B. | NaOH | C. | CaCl2 | D. | CO2 |
7.图中曲线表示短周期元素的原子序数(技递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是( )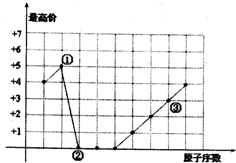

| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
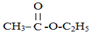 相关物质间转化关系如图:
相关物质间转化关系如图: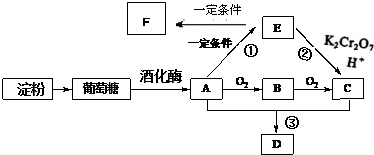
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$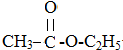 +H2O
+H2O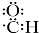

 .
. .
. .
.