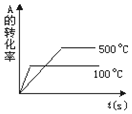
题目内容
16. 据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)(1)反应在5L的密闭容器中进行,2min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8g.则该段时间内H2的平均反应速率为0.018mol•(L•min)-1;
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是BCD;
A.CH4的转化率等于 CO的产率 B.混合气体的平均相对分子质量不变
C.v 正(CO):v 逆(H2)=1:2 D.固体的总质量不变
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g)?Fe(s)+CO2(g) K=0.5
若在 1L密闭容器中加入0.04mol FeO(s),并通入 x mol CO,t℃时反应达到平衡.此时FeO(s)的转化率为 50%,则x=0.06.
(4)在3L容积可变的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线Ⅰ所示.若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当通过改变压强使曲线Ⅰ变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为2L.
分析 (1)n(Fe2O3)=$\frac{4.8g}{160g/mol}$=0.03mol,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=$\frac{\frac{△n}{V}}{△t}$计算该段时间内氢气平均反应速率;
(2)可逆反应达到平衡状态时,该物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(4)参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=$\frac{x-0.02}{1}$mol/L、c(CO2)=0.02mol/L,
化学平衡常数K=$\frac{0.02}{x-0.02}$=0.5,据此计算x值;
(4)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L.
解答 解:(1)n(Fe2O3)=$\frac{4.8g}{160g/mol}$=0.03mol,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,v(H2)=$\frac{\frac{0.18mol}{5L}}{2min}$=0.018mol•(L•min)-1,
故答案为:0.018mol•(L•min)-1;
(2)A.CH4的转化率等于CO的产率时,该反应不一定达到平衡状态,故A错误;
B.混合气体的平均相对分子质量不变时,各物质的物质的量不变,该反应达到平衡状态,故B正确;
C.v正(CO):v逆(H2)=1:2时,同一物质的正逆反应速率相等,该反应达到平衡状态,故C正确;
D.固体的总质量不变时,该反应达到平衡状态,故D正确;
故选BCD;
(3)参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=$\frac{x-0.02}{1}$mol/L、c(CO2)=0.02mol/L,
化学平衡常数K=$\frac{0.02}{x-0.02}$=0.5,x=0.06,
故答案为:0.06;
(4)分析图象知t0时刻改变一个条件,曲线I变为曲线II,一氧化碳的平衡浓度没有变化而达平衡的时间缩短,改变的条件是加入催化剂;反应②为反应前后气体物质的量不变的反应,改变压强,平衡不移动,曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L.
故答案为:加入催化剂;2.
点评 本题考查化学平衡计算、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析计算能力,只有反应前后改变的物理量不变时可逆反应就达到平衡状态,会化学平衡常数的有关计算,题目难度不大.

| A. | 0.3molHNO3 | B. | 0.2molH3PO4 | ||
| C. | 3.01×1023个HNO3分子 | D. | 0.1molNH3 |
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
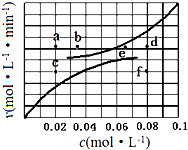 在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)?B(g)+C(g)△H=+285.1kJ•mol-1
反应时间(t)、容器内气体总压强(P)和A的物质的量浓度的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c(A)/(mol•L-1) | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
(1)上述反应能够自发进行的条件是高温.
(2)由总压强P和起始压强P0表示反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.根据表中数据计算平衡时A的转化率为73.9%.
(3)用气体的平衡分压(分压=总压×物质的量的分数)代替平衡浓度表示该反应的平衡常数的表达式KP=$\frac{{α}^{2}(A)}{[1+α(A)]×[1-α(A)]}P$(用含α(A)和P的式子表示).
(4)由总压强P和起始压强P0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=0.1×$\frac{P}{{P}_{0}}$mol,n(A)=0.1×(2-$\frac{P}{{P}_{0}}$)mol,根据上表计算a=0.026mol/L.
(5)由上述实验数据得到反应速率与反应物和生成物物质的量浓度的关系可用图表示.当升高到某一温度时反应重新达到平衡,相应的点分别为a、d.
 碳氧化物研究
碳氧化物研究(1)在体积可变 (活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)═CH3OH(g),测定不同条件、不同时间段内的CO的转化率,得到如表数据:
| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)< v(逆)(选填“>”、“<”或“=”).
③现有以下几种情况放入该体积可变的密闭容器中,请选出T2℃下达到的平衡状态与①中T2℃下的平衡状态一致的是
A、2mol H2+1molCO+1molCH3OH
B、0.5mol H2+1.5molCH3OH
C、1mol H2+1molCO+1molCH3OH
D、2mol H2+4molCH3OH
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7L/mol(用含a和b的代数式表示).
 (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应: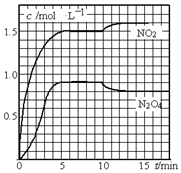 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应: