题目内容
13.实验室可用KMnO4和浓盐酸反应制取氯气.KMnO4+HCl(浓)═KCl+MnCl2+Cl2↑+H2O (未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目.
(2)将上述配平的化学方程式改写为离子方程式2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O.
(3)浓盐酸在反应中显示出来的性质是②
①只有还原性 ②还原性和酸性③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl1mol,转移的电子的数目约为1mol.
(5)一定条件下,KMnO4还可以氧化其他还原性物质.
MnO4-+C2O42-+16H+=Mn2++CO2↑+8H2O
完成上述离子方程式,此反应中,发生氧化反应的物质是C2O42-;若转移1mol电子,生成标准状况下CO222.4L.
分析 (1)根据氧化还原反应中电子守恒及质量守恒定律来配平,化合价升高,元素失电子,化合价降低,元素得到电子,化合价升高数=化合价降低数=转移电子数;
(2)将化学反应中的强电解质写成离子的形式,氯气和水应保留化学式来书写离子反应方程式;
(3)浓盐酸在反应中生成盐时表现酸性,生成氯气时表现还原性;
(4)根据Cl元素的化合价变化来计算转移的电子;
(5)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O.
解答 解:(1)KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O中,Mn元素的化合价由+7降低为+2价,Cl元素的化合价由-1价升高到0,化合价升高数=化合价降低数=转移电子数=10,根据电子守恒可知,MnCl2的化学计量数为2,Cl2的化学计量数为5,再根据质量守恒定律可知,配平的化学反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,单线桥表示反应中电子转移的方向和数目为 ,
,
故答案为: ;
;
(2)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,改为离子反应时Cl2和H2O应保留化学式,其余物质均写成离子形式,则离子反应为2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;
(3)由反应可知,盐酸参与反应生成KCl和MnCl2时表现其酸性,生成Cl2时表现其还原性,故答案为:②;
(4)Cl元素的化合价由-1价升高到0,产生0.5molCl2,则被氧化的HCl为0.5mol×2=1mol,转移的电子的物质的量为0.5mol×2×(1-0)=1mol,故答案为:1;1mol;
(5)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O,配平后离子方程式为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,其中C元素化合价由+3价升高为+4价,则C2O42-发生氧化反应,若转移1mol电子,生成标准状况下CO2为22.4L,故答案为:2;5;16H+;2;10;8H2O;C2O42-;22.4.
点评 本题考查氧化还原反应,明确元素的化合价及电子守恒、质量守恒定律即可解答,难度不大.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
| 主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(2)过量②的水溶液与⑦反应的离子方程式2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O
①请用双线桥标出电子转移的方向和数目;
②被氧化与未被氧化的H2SO4的物质的量之比为1:1,当电子转移0.1mol时,消耗还原剂的质量为3.2g.
(4)如图表示某同学配制480mL0.5mol/L的NaOH溶液的部分操作示意图,其中有错误的是C,这样操作所配制的溶液比要求的浓度要偏低 (填“偏高”、“偏低”、“不影响”).配制应称取10.0gNaOH.

 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
 碳氧化物研究
碳氧化物研究(1)在体积可变 (活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)═CH3OH(g),测定不同条件、不同时间段内的CO的转化率,得到如表数据:
| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)< v(逆)(选填“>”、“<”或“=”).
③现有以下几种情况放入该体积可变的密闭容器中,请选出T2℃下达到的平衡状态与①中T2℃下的平衡状态一致的是
A、2mol H2+1molCO+1molCH3OH
B、0.5mol H2+1.5molCH3OH
C、1mol H2+1molCO+1molCH3OH
D、2mol H2+4molCH3OH
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7L/mol(用含a和b的代数式表示).
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
| A. | 胶体化学可用于制备纳米材料 | |
| B. | 钛合金主要用于尖端领域 | |
| C. | 压电陶瓷可实现化学能与电能的转化 | |
| D. | 稀土元素大大改善合金性能被称为冶金工业的维生素 |
 (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应: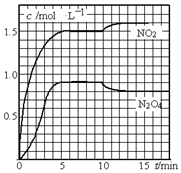 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应: