题目内容
11.某实验小组用下列装置进行乙醇催化氧化的实验.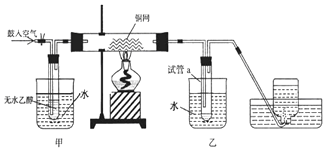
(1)实验过程中铜网出现红色和黑色交替的现象.用方程式解释该现象2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+CH3CH2OH$\stackrel{△}{→}$CH3CHO+Cu+H2O
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水.他们的作用依次为使乙醇受热挥发,冷凝生成的反应物
(3)反应进行一段时间后,试管a中能 收集到不同的物质,主要物质是CH3CHO(写出化学式),其中还含有一种液体,能使紫色石蕊试纸显红色,要除去该物质,可在混合液中加入c(填写字母)除去.
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳.
分析 (1)乙醇在铜做催化剂条件被氧气氧化成乙醛,属于加氧的氧化反应,方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,熄灭酒精灯,反应仍能继续进行,说明该反应是放热反应;
(2)依据乙醇和乙醛的物理性质:二者都容易挥发.乙醇是反应物,应转化成乙醇蒸汽进入到硬质试管内参与反应;乙醛是产物,降低温度使其转化成液态,所以前者用热水浴,后者用冷水浴;
(3)乙醇被氧化为乙醛,同时生成水,反应乙醇不能完全反应,故a中冷却收集的物质有乙醛、乙醇与水;能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应.
解答 解:(1)发生反应时,铜丝首先变黑,是因为发生反应:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;后来变红,发生反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,该反应是乙醇的催化氧化,铜在反应中做催化剂;熄灭酒精灯,反应仍能继续进行,说明该反应时一个放热反应,
故答案为:红;黑;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CuO+CH3CH2OH$\stackrel{△}{→}$CH3CHO+Cu+H2O;
(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发与空气中的氧气混合,有利于下一步反应;乙处作用为冷水浴,降低温度,使生成的乙醛冷凝成为液体,沉在试管的底部,
故答案为:使乙醇受热挥发;冷凝生成的反应物;
(3)乙醇被氧化为乙醛,同时生成水,反应乙醇不能完全反应,故a中冷却收集的物质有乙醛、乙醇与水,主要为乙醛,试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:CH3CHO;c.
点评 本题为乙醇化学性质的实验综合题,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及有机方程式书写、对装置的理解评价、物质的分离提纯等,难度中等,注意理解乙醇催化氧化原理.

 字词句段篇系列答案
字词句段篇系列答案| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
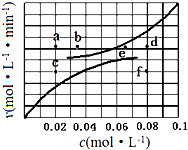 在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)?B(g)+C(g)△H=+285.1kJ•mol-1
反应时间(t)、容器内气体总压强(P)和A的物质的量浓度的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c(A)/(mol•L-1) | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
(1)上述反应能够自发进行的条件是高温.
(2)由总压强P和起始压强P0表示反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.根据表中数据计算平衡时A的转化率为73.9%.
(3)用气体的平衡分压(分压=总压×物质的量的分数)代替平衡浓度表示该反应的平衡常数的表达式KP=$\frac{{α}^{2}(A)}{[1+α(A)]×[1-α(A)]}P$(用含α(A)和P的式子表示).
(4)由总压强P和起始压强P0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=0.1×$\frac{P}{{P}_{0}}$mol,n(A)=0.1×(2-$\frac{P}{{P}_{0}}$)mol,根据上表计算a=0.026mol/L.
(5)由上述实验数据得到反应速率与反应物和生成物物质的量浓度的关系可用图表示.当升高到某一温度时反应重新达到平衡,相应的点分别为a、d.
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: .
. (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应: