题目内容
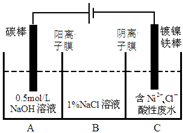 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
考点:电解原理
专题:电化学专题
分析:A、由图分析可知,碳棒与电源正极相连是电解池的阳极,电极反应4OH--4e-=2H2O+O2↑;
B、镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大;
C、又因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH;
D、若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl- --2e-=Cl2↑,电解反应总方程式会发生改变.
B、镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大;
C、又因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH;
D、若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl- --2e-=Cl2↑,电解反应总方程式会发生改变.
解答:
解:A、由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH--4e-=2H2O+O2↑,故A正确;
B、镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故B错误;
C、因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,故C正确;
D、若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl- --2e-=Cl2↑,电解反应总方程式会发生改变,故D正确;
故选B.
B、镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故B错误;
C、因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,故C正确;
D、若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl- --2e-=Cl2↑,电解反应总方程式会发生改变,故D正确;
故选B.
点评:本题考查了电解池原理的分析判断,主要是电解反应,电解产物判断,电解过程中溶液酸碱性的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、氯化铁溶液与氢氧化钠溶液:Fe3++3OH-═Fe(OH)3↓ |
如图所示的实验装置或操作不能达到实验目的是( )
 |
 |
 |
 |
| A.配制100mL 0.1mol/L盐酸 |
B. 验证AgCl和Ag2S的溶解性 | C.测定中和反应 的反应热 |
D.实验室制取 并收集氨气 |
| A、A | B、B | C、C | D、D |
化学兴趣小组利用如图装置进行电化学实验,下列预期现象正确的是( )


| A、X和Y与电流表连接,将Zn换成Fe,测得电流更大 |
| B、X和Y与电流表连接,将盐桥换成铜线,电流表指针偏转 |
| C、X和Y分别与电源“+”、“-”极相连,Cu极质量增大 |
| D、X和Y分别与电源“-”、“+”极相连,盐桥中阴离子向Zn极移动 |
化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A、减少CO2的排放,可以减少酸雨的产生 |
| B、减少SO2的排放,可以从根本上消除雾霾 |
| C、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| D、用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )


| A、装置I,铜片上有O2逸出 |
| B、装置I,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+═Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从锌电极流向铜电极 |
室温下,下列说法正确的是( )
| A、pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9mol/L |
| B、pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C、同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D、0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
对反应:2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,下列判断不正确的是( )
| A、该反应的还原剂是Cu2S |
| B、当1mol O2发生反应时,还原剂所失去电子的物质的量为4mol |
| C、O2发生了氧化反应 |
| D、CuSO4即是氧化产物,又是还原产物 |


 的同分异构体的结构简式
的同分异构体的结构简式 ,请设计合成路线,要求不超过4步(无机试剂任选)
,请设计合成路线,要求不超过4步(无机试剂任选)