题目内容
如图所示的实验装置或操作不能达到实验目的是( )
 |
 |
 |
 |
| A.配制100mL 0.1mol/L盐酸 |
B. 验证AgCl和Ag2S的溶解性 | C.测定中和反应 的反应热 |
D.实验室制取 并收集氨气 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.配制100mL溶液需要100mL容量瓶,转移液体利用玻璃棒引流;
B.硝酸银过量,再加Na2S生成沉淀,不能发生沉淀的转化;
C.环形搅拌棒搅拌,利用温度计测定起始、最高温度,且隔热措施好;
D.氯化铵与氢氧化钙反应生成氨气,利用向下排空气收集.
B.硝酸银过量,再加Na2S生成沉淀,不能发生沉淀的转化;
C.环形搅拌棒搅拌,利用温度计测定起始、最高温度,且隔热措施好;
D.氯化铵与氢氧化钙反应生成氨气,利用向下排空气收集.
解答:
解:A.配制100mL溶液需要100mL容量瓶,转移液体利用玻璃棒引流,图中溶液配制装置和操作合理,故A正确;
B.硝酸银过量,再加Na2S生成沉淀,不能发生沉淀的转化,则不能比较溶度性大小,故B错误;
C.环形搅拌棒搅拌,利用温度计测定起始、最高温度,且隔热措施好,图中装置和操作合理,故C正确;
D.氯化铵与氢氧化钙反应生成氨气,利用向下排空气收集,图中装置和操作合理,故D正确;
故选B.
B.硝酸银过量,再加Na2S生成沉淀,不能发生沉淀的转化,则不能比较溶度性大小,故B错误;
C.环形搅拌棒搅拌,利用温度计测定起始、最高温度,且隔热措施好,图中装置和操作合理,故C正确;
D.氯化铵与氢氧化钙反应生成氨气,利用向下排空气收集,图中装置和操作合理,故D正确;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及溶液的配制、沉淀的生成和转化、中和热测定、氨气的制备等,侧重实验基本操作和实验原理的考查,注意实验的操作性、评价性分析,选项B为易错点,题目难度不大.

练习册系列答案
相关题目
研究人员最近发现了一种“水”电池,这种电池能利用淡水和海水之间含盐量的差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A、Ag发生还原反应 |
| B、正极反应式:5MnO2+2e-=Mn5O102- |
| C、每生成1mol AgCl转移2mol电子 |
| D、Cl-不断向“水”电池的正极移动 |
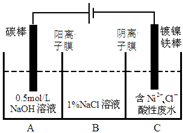 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
现有常温下的四份溶液:①0.01mol/L CH3COOH溶液;②0.01mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
用NA表示阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:D-2 O-16 Cu-64)( )
| A、18g的D216O中含有的中子数为9NA |
| B、物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA |
| C、33.6L NO2溶于足量的水得到的溶液中含有的NO3-数为NA |
| D、32g铜发生氧化还原反应,一定失去NA个电子 |
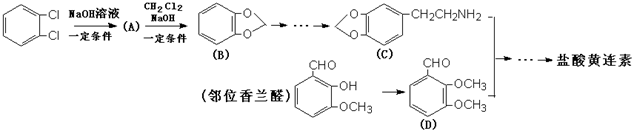


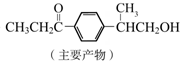 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为