题目内容
某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )


| A、装置I,铜片上有O2逸出 |
| B、装置I,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+═Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从锌电极流向铜电极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,形成原电池时,锌为负极,铜为正极,负极发生氧化反应,电极反应为Zn-2e-=Zn2+,正极发生还原反应,如电解质溶液为硫酸铜,则发生Cu2++2e-=Cu,电解质溶液为硫酸,则发生2H++2e-=H2↑,以此解答该题.
解答:
解:A.装置I,铜片上发生2H++2e-=H2↑,有H2逸出,故A错误;
B.装置I,锌片溶解,发生氧化反应,为原电池的负极,故B错误;
C.装置Ⅱ,负极为Zn-2e-=Zn2+,正极发生Cu2++2e-=Cu,电池总反应为:Zn+Cu2+═Zn2++Cu,故C正确;
D.装置Ⅱ,锌为负极,铜为正极,外电路中,电子从锌电极流向铜电极,故D正确.
故选CD.
B.装置I,锌片溶解,发生氧化反应,为原电池的负极,故B错误;
C.装置Ⅱ,负极为Zn-2e-=Zn2+,正极发生Cu2++2e-=Cu,电池总反应为:Zn+Cu2+═Zn2++Cu,故C正确;
D.装置Ⅱ,锌为负极,铜为正极,外电路中,电子从锌电极流向铜电极,故D正确.
故选CD.
点评:本题考查原电池知识,为高频考点,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍.下列说法不正确的是( )
| A、X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B、Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C、X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D、Z的氢化物比X的氢化物更稳定 |
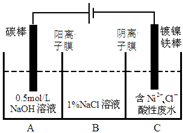 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
现有常温下的四份溶液:①0.01mol/L CH3COOH溶液;②0.01mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
下列解释事实的离子方程式不正确的是( )
| A、氯化铜溶液显酸性:Cu2++2H2O?Cu(OH)2+2H+ |
| B、氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2Cl-+I2 |
| C、向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-?Al(OH)3↓ |
| D、实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2OH-?SiO32-+H2O |

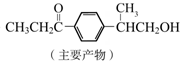 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛.