题目内容
化学兴趣小组利用如图装置进行电化学实验,下列预期现象正确的是( )


| A、X和Y与电流表连接,将Zn换成Fe,测得电流更大 |
| B、X和Y与电流表连接,将盐桥换成铜线,电流表指针偏转 |
| C、X和Y分别与电源“+”、“-”极相连,Cu极质量增大 |
| D、X和Y分别与电源“-”、“+”极相连,盐桥中阴离子向Zn极移动 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:X和Y与电流表连接,可形成原电池反应,两个电极的金属活动性相差越大,则越易形成原电池反应,电流更大,如外界电源,则形成电解池,阳极发生氧化反应,阴极发生还原反应,电解时,阳离子向阴极移动,阴离子向阳极移动,以此解答该题.
解答:
解:A.将Zn换成Fe,则原电池的两极金属活泼性相差较小,电流变小,故A错误;
B.X和Y与电流表连接,将盐桥换成铜线,不能形成自发进行的氧化还原反应,则电流表指针不偏移,故B错误;
C.X和Y分别与电源“+”、“-”极相连,锌为阳极,铜为阴极,阴极发生Cu2++2e-=Cu,质量增大,故C正确;
D.X和Y分别与电源“-”、“+”极相连,锌为阴极,铜为阳极,阴离子向阳极,即铜极移动,故D错误.
故选C.
B.X和Y与电流表连接,将盐桥换成铜线,不能形成自发进行的氧化还原反应,则电流表指针不偏移,故B错误;
C.X和Y分别与电源“+”、“-”极相连,锌为阳极,铜为阴极,阴极发生Cu2++2e-=Cu,质量增大,故C正确;
D.X和Y分别与电源“-”、“+”极相连,锌为阴极,铜为阳极,阴离子向阳极,即铜极移动,故D错误.
故选C.
点评:本题考查较为综合,涉及原电池和电解池知识,侧重于学生的分析能力的考查,为高考高频考点,注意把握原电池的原理和电极反应,注重相关基础知识的积累,难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
解释下列事实的化学用语正确的是( )
| A、将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3?H2O?NH4++OH- | ||||
B、铜与浓硫酸共热产生气体:Cu+H2SO4(浓)
| ||||
| C、CH3COONa的水溶液呈碱性:CH3COO-+H2O═CH3COOH+OH- | ||||
| D、用NaOH溶液吸收Cl2:Cl2+2OH-═2Cl-+H2O |
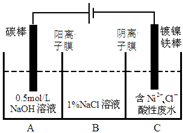 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
下列解释事实的离子方程式不正确的是( )
| A、氯化铜溶液显酸性:Cu2++2H2O?Cu(OH)2+2H+ |
| B、氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2Cl-+I2 |
| C、向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-?Al(OH)3↓ |
| D、实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2OH-?SiO32-+H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | ||
| B、10mol?L-1的浓氨水:Al3+、NH4+、NO3-、I- | ||
| C、0.1 mol?L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | ||
D、
|

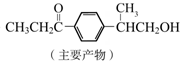 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为