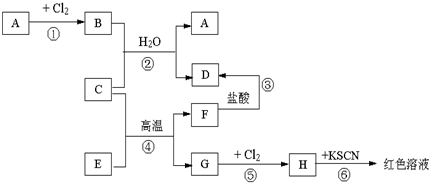
题目内容
16.将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
分析 A.硫化氢和二氧化硫反应生成硫单质;
B.氨气显碱性,能和二氧化碳反应生成碳酸铵,碳酸根离子结合钡离子生成碳酸钡沉淀;
C.二氧化碳不和BaCl2溶液反应,通入氯气不能反应,无沉淀生成;
D.氯气和二氧化硫在水溶液中发生氧化还原反应得到两种强酸溶液.
解答 解:A.发生2H2S+SO2═3S↓+H2O,有沉淀生成,故A不选;
B.2NH3+H2O+CO2═(NH4)2C03,(NH4)2C03+BaCl2═BaCO3↓+2NH4Cl,故B不选;
C.二氧化碳不和BaCl2溶液反应,通入氯气不能反应,无沉淀生成,故C选;
D.Cl2+SO2+2H2O═H2SO4+2HCl,H2SO4+BaCl2═BaSO4↓+2HCl,故D不选;
故选C.
点评 本题考查物质的性质,侧重元素化合物性质的考查,涉及氯气、二氧化硫、氨气、二氧化碳与氯化钡的性质,综合性较强,注意发生的氧化还原反应及复分解反应即可解答,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
7.Al65Cu23Fe12是一种具有凸多面体规则外形的固态物质,它具有合金的某些优良性能.有关该物质的说法中不正确的是( )
| A. | Al65Cu23Fe12的硬度比金属Al、Cu、Fe的硬度大 | |
| B. | Al65Cu23Fe12中三种金属的化合价均可视作零 | |
| C. | Al65Cu23Fe12不可用作长期浸泡在海水中的材料 | |
| D. | 1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子 |
4.下列实验操作中正确的是( )
| A. | 用规格为10mL的量筒量取6.20mL的液体 | |
| B. | 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| C. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| D. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
11.水热法制直径为1到100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A. | a=4 | |
| B. | S2O32-是还原剂 | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
1.工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:
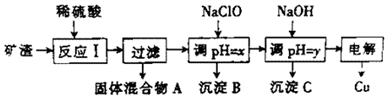
已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
(1)反应I中,与铁元素有关反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+.
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.

已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
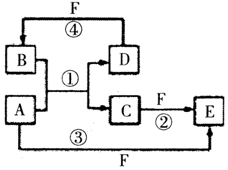 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题:
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.