题目内容
1.已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式如下:C(石墨)+O2(g)=CO2(g);△H=-393.51kJ•mol-1; C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ•mol-1,下列说法正确的是( )| A. | 金刚石比石墨稳定 | B. | 石墨转化为金刚石需要吸热 | ||
| C. | 金刚石燃烧产物更稳定 | D. | 等质量时,石墨所含能量高 |
分析 由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g);△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,根据反应热比较金刚石与石墨的能量大小,以此解答该题.
解答 解:由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,则由石墨制备金刚石是吸热反应,石墨的能量低于金刚石,所以石墨比金刚石更高稳定,故B正确.
故选B.
点评 本题考查热化学方程式的书写及应用,为高频考点,侧重考查学生的分析能力,题目难度不大,注意物质的稳定性与能量的关系.

练习册系列答案
相关题目
7.钓鱼诸岛自古以来就是中国的领土,该岛附近蕴藏着大量石油和天然气.下列关于石油及石油炼制的叙述中,错误的是( )
| A. | 石油主要含碳、氢元素,是烷烃、环烷烃、芳香烃的混合物 | |
| B. | 石油中含有C5~C11的烷烃,可以通过石油的常压分馏得到汽油 | |
| C. | 含C20以上烷烃的重油经减压分馏可以得到煤油和柴油 | |
| D. | 石油经分馏得到的各馏分仍是多种烃的混合物 |
12. 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )| A. | 100mol | B. | 250mol | C. | 500mol | D. | 1000 mol |
9.下列实验操作、实验现象及对应的实验结论都正确的一组是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将CO2通入CaCl2溶液中 | 产生白色沉淀 | CaCO3难溶于水 |
| B | 向某溶液滴加少量稀盐酸 | 溶液中出现白色沉淀 | 该溶液中一定存在Ag+ |
| C | 向AgCl沉淀中滴加NaBr溶液 | 白色沉淀转化为浅黄色沉淀 | Ksp(AgCl)>Ksp(AgBr) |
| D | 将苯滴加到溴水中 | 溴水褪色 | 苯和溴发生了取代反应 |
| A. | A | B. | B | C. | C | D. | D |
16.短周期元素W、X、Y、Z的原子序数依次增大.四种元素原子的最外层电子数之和为20,W的阴离子与X的阳离子电子层结构相同,Y的最高正价与最低负价代数和为0,Z的最外层电子数是X最外层电子数的2倍.下列说法不正确的是( )
| A. | 简单离子的半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:W>Z>Y | |
| C. | 最高价氧化物对应水化物的酸性:Z>Y>X | |
| D. | W与Y形成的化合物中只含共价键 |
6.下列反应的离子方程式书写正确的是( )
| A. | 铁粉与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | Cu(OH)2固体与稀硫酸反应:OH-+H+═H2O | |
| D. | 铝片与NaOH溶液反应:Al+OH-+H2O═AlO2-+H2↑ |
11.在pH=13的溶液中能大量共存的是( )
| A. | NH4+、SO42-、Cl- | B. | Al3+、NO3-、Cl- | C. | K+、Fe3+、SO42- | D. | Na+、CO32-、NO3- |
 ;B与E形成的化合物
;B与E形成的化合物 ;A、B、E形成的化合物Na+
;A、B、E形成的化合物Na+ ;D、E形成的化合物
;D、E形成的化合物 .
.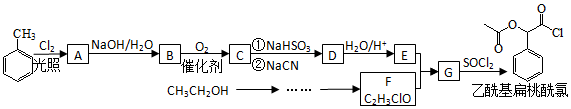
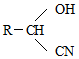 ;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′