题目内容
6.下列反应的离子方程式书写正确的是( )| A. | 铁粉与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | Cu(OH)2固体与稀硫酸反应:OH-+H+═H2O | |
| D. | 铝片与NaOH溶液反应:Al+OH-+H2O═AlO2-+H2↑ |
分析 A.铁粉与稀H2SO4反应生成亚铁离子;
B.碳酸钠与足量盐酸反应生成氯化钠、二氧化碳和水;
C.稀的强酸与稀的强碱反应生成可溶性盐和水的离子反应可用H++OH-=H2O表示,氢氧化铜为难溶物,应写化学式;
D.Al、NaOH、水反应生成偏铝酸钠和氢气,Al、水、氢气在离子反应中保留化学式,方程式左右氢原子不守恒.
解答 解:A.铁粉与稀H2SO4反应生成硫酸亚铁、氢气,反应的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.碳酸钠为可溶性的盐,盐酸为强酸,二者反应生成可溶性的氯化钠,其离子方程式可以用CO32-+2H+═H2O+C02↑表示,故B正确;
C.Cu(OH)2与稀硫酸反应,氢氧化铜是难溶物,应写化学式,H++OH-=H2O不符合,正确的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,故C错误;
D.金属铝与氢氧化钠溶液反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意电解质的强弱及离子反应中应保留化学式的物质即可解答,题目难度不大.

练习册系列答案
相关题目
14.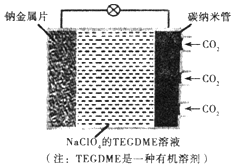 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )| A. | 充电时,Na+从阳极向阴极移动 | |
| B. | 可以用乙醇代替TEGDME做有机溶剂 | |
| C. | 放电时,当转移lmol电子负极质量减轻23g | |
| D. | 放电时,正极反应为3CO2+4Na++4e-=2Na2CO3+C |
1.已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式如下:C(石墨)+O2(g)=CO2(g);△H=-393.51kJ•mol-1; C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ•mol-1,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | B. | 石墨转化为金刚石需要吸热 | ||
| C. | 金刚石燃烧产物更稳定 | D. | 等质量时,石墨所含能量高 |
11.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图1:
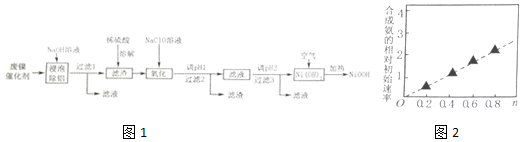
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH1”时,溶液pH范围为5.6~6.2;过滤2所得滤渣的成分Cr(OH)3和Fe(OH)3(填化学式).
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{充电}^{放电}$MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O;放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{充电}^{放电}$MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O;放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.
18.下列有机反应方程式中,不正确的是( )
| A. | 丙烯与Br2加成:CH2═CHCH3+Br2→CH2BrCH2CH2Br | |
| B. | 甲烷与Cl2发生取代反应:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 催化裂化:C16H34$→_{△}^{催化剂}$C8H16+C8H18 | |
| D. | 淀粉水解:(C6H10O5)n+nH2O$\stackrel{催化剂}{→}$nC6H12O6 |
15.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中能大量共存的一组离子正确的是( )
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量Cl2:Fe2+、Na+、Cl-、SO42- | |
| D. | 通入过量SO2:Fe2+、H+、SO32-、SO42- |
 氨气是一种重要的化工原料,氨态氮肥是常用的肥料.
氨气是一种重要的化工原料,氨态氮肥是常用的肥料. NH3•H2O
NH3•H2O NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.
NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色. NH3•H2O+H+
NH3•H2O+H+