题目内容
16.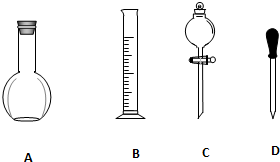 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.(1)在如图所示仪器中,配制上述溶液肯定需要的是BD(填序号),除此之外,配制上述溶液还需要的玻璃仪器是容量瓶烧杯和玻璃棒.
(2)在容量瓶的使用方法中,下列操作正确的是A、E.
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)实验室有250mL、500mL、1000mL的容量瓶,配制900mL 0.1mol/LNaOH溶液时应选用1000mL容量瓶.
(4)根据计算得知,用托盘天平称取的烧碱质量为4.0g,需用量筒量取质量浓度为1mol/L浓硫酸的体积为2.5mL.
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,判断缺少的仪器;
(2)容量瓶是一种精密仪器,容积会随着温度的改变而改变,故不能盛放过热或者过冷的液体,不能溶解固体和稀释浓溶液,在使用前应查漏,据此分析;
(3)容量瓶在实验室中常见的规格有50mL、100mL、250mL、500mL、1000mL等,实验室中没有950mL规格的,所以在配制溶液时应该选取稍大的容量瓶;
(4)依据m=CVM计算需要溶质的质量,依据C=$\frac{1000ρw}{M}$计算浓硫酸的物质的量浓度,溶液稀释前后所含溶质的物质的量不变,据此计算需要浓硫酸的体积.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量或者量取、溶解或者稀释、移液、洗涤、定容等,用到的仪器:托盘天平和药匙或者量筒、烧杯、玻璃棒、容量瓶、胶头滴管;配制0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL,肯定需要的仪器是量筒和胶头滴管,除此之外,配制上述溶液还需要的玻璃仪器是容量瓶、烧杯和玻璃棒,
故答案为:BD;烧杯;玻璃棒;
(2)A、容量瓶带有活塞,使用前应检验容量瓶是否漏液,故A正确;
B、容量瓶用水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C、容量瓶不能用来溶解固体,故C错误;
D、容量瓶不能用来稀释浓溶液,故D错误;
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确.
故选:AE;
(3)容量瓶在实验室中常见的规格有50mL、100mL、250mL、500mL、1000mL等,配制950mL的溶液,为减小误差,应该一次性配制完成,故应选用稍大于900mL,即选用1000mL容量瓶,
故答案为:1000;
(4)0.1mol/L NaOH溶液900mL,选用1000mL容量瓶,需要氢氧化钠的质量m=0.1mol/L×1L×40g/mol=4.0g;根据C 1 V 1=C2V2,1mol/L×V 1=0.5mol/L×500mL,V 1=250mL,
故答案为:4.0;250.
点评 本题考查一定物质的量浓度溶液的配制、化学方程式的相关计算,注意容量瓶的使用、注意正确判断产物的成分为解答该题的关键,题目难度不大.

| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |

| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是abdc(填编号)
(2)在Na2CO3溶液中通入少量的SO2气体,写出离子方程式2CO32-+SO2+H2O═2HCO3-+SO32-
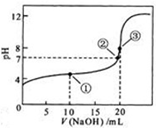
(3)用0.1000mol/L NaOH溶液滴定0.1000mol/L 20mL CH3COOH溶液,得到如图曲线在②时,溶液中离子浓度大小顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
在①时,测得pH约为5,c(CH3COO-)-c(Na+)=10-5-10-9mol/L(填精确数值)
(4)常温下,CH3COOH与NH3.H2O的电离平衡常数均为1.8×10-5,则NH4HCO3溶液呈碱性.
溴水.
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
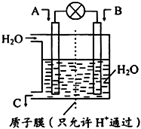 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
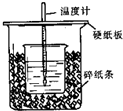 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: