题目内容
9.用磷铁矿合成阻燃剂THPC{[p(CH2OH)4]Cl}的工艺流程如下:
回答下列问题:
(1)步骤①球磨的目是将物料粉碎并混合均匀.
(2)步骤②在高温下发生反应的化学方程式为2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+10CO↑+P4 ,该反应需在真空条件下进行的原因是白磷能够自燃.
(3)步骤③发生反应的离子方程式为P4+3OH-+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+3H2PO2-.
(4)副产物NaH2PO2水解的离子方程式为H2PO2-+H2O?H3PO2+OH-.
(5)步骤④发生反应的化学方程式为PH3+4HCHO+HCl=[P(CH2OH)4]Cl.
分析 根据题干流程图提示的信息,可知各反应的反应物、生成物,所以用磷铁矿合成阻燃剂:磷酸钙、二氧化硅、焦炭研磨混合,发生反应:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+10CO↑+P4 ,在碱反应器中:P4+3NaOH+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+3NaH2PO2,反应④:PH3+4HCHO+HCl=[P(CH2OH)4]Cl.
(1)球磨利用下落的研磨体的冲击作用和研磨体与内壁的研磨作用而将物料粉碎并混合;
(2)步骤②在高温下磷酸钙和二氧化硅、焦炭反应生成硅酸钙、一氧化碳和白磷;白磷的着火点是40℃,易自发燃烧;
(3)白磷在碱性条件下反应生成磷化氢和亚磷酸氢根离子;
(4)亚磷酸二氢钠为强碱弱酸盐,水解生成亚磷酸和碱;
(5)磷化氢和甲醛在浓盐酸中合成阻燃剂.
解答 解:(1)磷酸钙、二氧化硅、焦炭利用球磨研磨混合均匀,以便下一步在真空炉中进行充分反应,
故答案为:将物料粉碎并混合均匀;
(2)根据题干流程图提示的信息,可知步骤②反应物为磷酸钙、二氧化硅、焦炭,生成物为硅酸钙、一氧化碳和白磷,所以反应为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+10CO↑+P4 ,白磷的着火点是40℃,能够自燃,所以该反应需在真空条件下进行,
故答案为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+10CO↑+P4 ;白磷能够自燃;
(3)白磷在碱性条件下发生歧化反应,生成磷化氢和亚磷酸氢根离子,反应为:P4+3OH-+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+3H2PO2-,
故答案为:P4+3OH-+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+3H2PO2-;
(4)亚磷酸二氢钠为强碱弱酸盐,水解呈碱性,水解离子方程式为:H2PO2-+H2O?H3PO2+OH-,
故答案为:H2PO2-+H2O?H3PO2+OH-;
(5)步骤④中磷化氢和甲醛在浓盐酸中发生反应:PH3+4HCHO+HCl=[P(CH2OH)4]Cl,生成阻燃剂,
故答案为:PH3+4HCHO+HCl=[P(CH2OH)4]Cl.
点评 本题考查了阻燃剂的工艺流程的分析应用,掌握题干信息、物质性质和过程实验操作,流程分析判断是解题关键,题目难度中等.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案| A. | 甲烷的燃烧 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
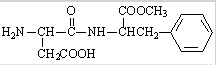 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )| A. | 在适当催化剂作用下可形成高分子化合物 | |
| B. | 该有机物完全燃烧时生成CO2、H2O、NH3 | |
| C. | 1mol该有机物在盐酸中发生水解反应时最多消耗2molH+ | |
| D. | 1mol该有机物最多能与3molNaOH反应 |
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 化学反应速率的单位由时间单位和物质的量单位决定 | |
| C. | 离子键的本质是静电作用,只能存在于由阴,阳离子构成的物质中 | |
| D. | 可将金属钠在研体中研成粉末,使钠与水反应的实验更安全 |
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
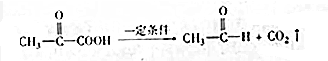


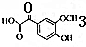
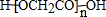
 ,
, 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题: