题目内容
18.下列各组物质或物质间反应可能包括多步反应,其总的离子方程式正确的是( )| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
分析 A、NaClO溶液具有氧化性,能将SO2氧化;
B、多元弱酸盐分步水解;
C、钠先和盐中的水反应,然后生成的氢氧化钠再和氯化铝反应;
D、明矾溶液中铝离子和硫酸根离子的物质的量之比为1:2.
解答 解:A、NaClO溶液具有氧化性,能将SO2氧化,生成硫酸,不生成HSO3-,故A错误;
B、Na2S投入水中:S2-+H2O?HS-+OH-,故B错误;
C、钠先和盐中的水反应,然后生成的氢氧化钠再和氯化铝反应,即Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故C正确;
D、明矾溶液中铝离子和硫酸根离子的物质的量之比为1:2,向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全时的反应为:Al3++2S042-+2Ba2++4OH-═[Al(OH)4]-↓+2BaSO4↓,故D错误.
故选C.
点评 本题考查离子方程式的书写,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握离子的反应必须符合反应的实际,注意电荷守恒和质量守恒问题,难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
8.pH=3的两种酸溶液A、B,取等体积酸分别与足量的锌反应,酸A比酸B产生的氢气的量多.下列说法正确的是( )
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
9.常温下,将11.2g由CO2、CH4O、CO三种气体组成的混合气体直接通入到足量的Na2O2固体中,充分反应后,使Na2O2固体增重5.6g;若将同样的一组气体经过足量氧气充分燃烧后,再将燃烧后的气体混合物通入到足量的Na2O2固体中,充分反应后,使Na2O2固体增重为( )
| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
6.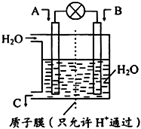 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的△H<0(填“>”或“<”),实验2条件下平衡常数K=0.17.
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
7.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质的与水反应时钠最剧烈 | D. | 原子半径逐渐增大 |
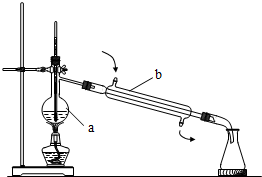 (1)写出如图所指仪器的名称:
(1)写出如图所指仪器的名称: