题目内容
16.下列物质反应后一定有+3价铁生成的是( )①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ①②④ |
分析 ①Cl2具有强氧化性,能将变价金属氧化成高价;
②Fe与过量稀H2SO4反应生成二价铁离子,再向其中加KNO3,相当于硝酸,氧化亚铁离子生成铁离子;
③S具有弱氧化性,将变价金属氧化成低价态;
④Fe(NO3)2溶液中加少量盐酸,相当于硝酸,氧化亚铁离子生成铁离子;
⑤Fe和Fe2O3的混合物溶于盐酸中,铁过量只有亚铁离子.
解答 解:①过量的Fe与Cl2加热时发生反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3,故①正确;
②Fe与过量稀H2SO4反应后生成硫酸亚铁,再向其中加KNO3,在酸性溶液中硝酸根能氧化亚铁离子转化为铁离子,4H++NO3-+3Fe2+=NO↑+3Fe3++4H2O,故②正确;
③Fe与过量的S加热时发生反应生成FeS,Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,故③错误;
④Fe(NO3)2溶液中加少量盐酸,在酸性溶液中硝酸根能氧化亚铁离子转化为铁离子,故④正确;
⑤Fe和Fe2O3的混合物溶于盐酸中由于不能确定铁是否过量,则不能确定是否产生铁离子,故⑤错误,
故选D.
点评 本题考查铁及其化合物转化的有关判断,掌握铁及其化合物转化是解答关键,侧重考查学生灵活运用基础知识解决实际问题的能力,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应发生过程中要不断从外界获得能量,放热反应不需要吸收外界能量 | |
| D. | 是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 |
12.用铜、铬的氧化物作催化剂,HCl制Cl2的原理为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1,下列说法正确的是( )
| A. | 平衡时,将生成的水蒸气除去,有利于提高HCl的转化率 | |
| B. | 在恒容绝热容器中进行时,随着反应的进行,气体的压强一定不断减小 | |
| C. | 恒压容器中,反应到平衡后通入惰性气体,平衡不移动 | |
| D. | 平衡时,其他条件不变,增大催化剂用量,反应的平衡常数将变大 |
1.有甲、乙、丙三种溶液,进行如下操作:Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀溶解丙产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液中溶质可能是( )
则甲、乙、丙三种溶液中溶质可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、NaCl |
5.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 71gCl2所含原子数为NA | |
| C. | 在常温常压下,1molNe含有的原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
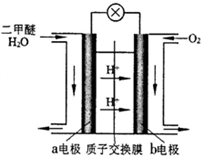 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
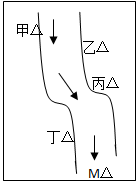 在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.
在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.