题目内容
8.等质量的氧气和臭氧(O3),它们的物质的量之比为3:2,所含分子数之比为3:2,所含原子数之比为1;1.分析 依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合氧气、臭氧分子构成解答.
解答 解:依据n=$\frac{m}{M}$可知,物质的量与摩尔质量成反应,所以等质量的氧气和臭氧(O3),它们的物质的量之比为:48:32=3:2;
依据N=nNA可知:物质所含分子数与物质的量成正比,所含分子数与为:3:2;
氧气为双原子分子,臭氧为三原子分子,等质量的氧气和臭氧(O3),物质的量之比为:3:2,原子数之比为:3×2:2×3=1:1;
故答案为:3:2;3:2;1:1.
点评 本题考查物质的量的相关计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
相关题目
3.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 含lmolH2SO4的浓硫酸与足量铜在加热条件下反应,转移的电子总数为NA | |
| B. | 0.1 L0.5mol/LCH3COOH 溶液中含有的氢离子为0.05NA | |
| C. | 粗铜精炼时阳极质量减少6.4g,则外电路上通过0.2NA电子 | |
| D. | 1molCH3COONa和少量CH3COOH溶于水所得到的中性溶液中,CH3COO-的数目为NA |
16.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ①②④ |
3.下列有关溶液组成的描述合理的是( )
| A. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
13.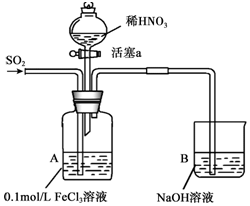 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如表:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如表:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.
20.下列有关描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气 | |
| C. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.4 g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8 NA | |
| B. | 标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5 NA | |
| C. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1 NA | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05 NA |
18.同温同压下,同物质的量的CH4气体与CO体积比是( )
| A. | 3:1 | B. | 1:1 | C. | 1:3 | D. | 2:3 |
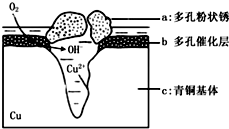 图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.
图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.