题目内容
20.下列表示物质结构的化学用语正确的是( )| A. | 8个中子的碳原子的核素符号:12C | B. | HF的电子式: | ||
| C. | 氯化镁  | D. | Cl-离子的结构示意图: |
分析 A、质量数=质子数+中子数;
B、HF为共价化合物;
C、氯化镁为离子化合物;
D、氯离子是由氯原子得一个电子形成.
解答 解:A、碳原子含有8个中子,质量数应该是8+6=14,故核素符号为14C,故A错误;
B、氟化氢中H原子和F原子间以共价键结合,故HF的电子式为 ,故B错误;
,故B错误;
C、氯化镁为离子化合物,由2个氯离子和1个镁离子构成,由于相同离子不能合并,故电子式为 ,故C正确;
,故C正确;
D、氯离子是由氯原子得一个电子形成,故氯离子的结构示意图为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了常见的化学用语,难度不大,应注意的是离子是由原子得失电子形成的,质子数不变.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
10.T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示.则下列结论正确的是( )
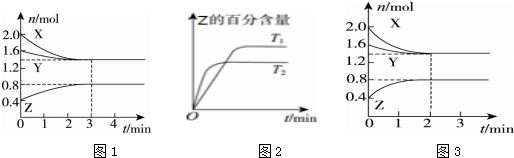

| A. | 容器中发生的反应可表示为3X(g)+Y(g)═2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol/(L•min) | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
11.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L NO2溶于水完全反应转移电子数为0.2NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.6NA的乙烯分子中含有的π键数为0.2NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
8.下列关于价电子构型3s23p4的描述正确的是( )
| A. | 该元素的电负性是同主族最大的 | |
| B. | 其轨道表示式为 | |
| C. | 可以与H2化合生成液态化合物 | |
| D. | 它的核外电子排布式为1s22s22p63s23p4 |
15.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
| A. | 高铁酸钾中铁显+3价 | |
| B. | 湿法中每生成1mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1mol Na2FeO4转移4 mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质 |
5.含NO3-的工业废水会造成水体富营养化,可利用如下反应将其转化为NH3:Al+口+口+口→口+口,反应中涉及到的另外3种微粒是H2O、AlO2-、OH-.下列说法正确的是( )
| A. | 反应中的Al被还原,NO3-是还原剂 | |
| B. | 产物分别是NH3、AlO2-和OH- | |
| C. | 若有4mol Al参加反应,则有1.5mol NO3-被还原 | |
| D. | 随着反应的进行,溶液的碱性逐渐增强 |
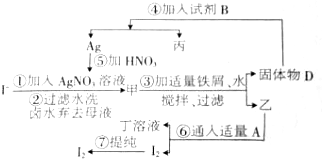 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘:
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘: