题目内容
10. 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘:
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘:回答下列问题:
(1)已知A是一种常见气体单质,则A的化学式是Cl2.
(2)第①步骤作中加入AgNO3溶液时发生的主要反应的化学方程式是AgNO3+NaI=AgI↓+NaNO3.
(3)提取碘的流程中,第④步操作中加入的试剂B是稀H2SO4,加入该试剂进行浸洗的目的是除去未反应的Fe.
(4)上述工艺流程中可以循环使用的一种金属单质是Ag.
分析 由流程可知,富碘卤水中加入硝酸银溶液过滤、洗涤得到甲为AgI,加入铁屑、水反应生成单质Ag和FeI2,可知乙为FeI2,通入适量氯气反应生成I2,则丁为FeCl3,再利用碘单质易升华,易溶解于有机溶剂中提纯碘单质;④中Ag稀硫酸清洗Ag,Fe与稀硫酸反应生成丙为硫酸亚铁,
(1)乙为FeI2,通入适量氯气反应生成I2,A为氯气;
(2)第①步骤作中加入AgNO3溶液时发生的主要反应是碘离子和银离子生成碘化银沉淀;
(3)Ag中可能混合有过量Fe,则第④步操作中用稀H2SO4浸洗除去;
(4)过程中参与反应最后又生成的可以循环使用.
解答 解:由流程可知,富碘卤水中加入硝酸银溶液过滤、洗涤得到甲为AgI,加入铁屑、水反应生成单质Ag和FeI2,可知乙为FeI2,通入适量氯气反应生成I2,则丁为FeCl3,再利用碘单质易升华,易溶解于有机溶剂中提纯碘单质;④中Ag稀硫酸清洗Ag,Fe与稀硫酸反应生成丙为硫酸亚铁,
(1)由上述分析可知,已知A是一种常见气体单质,则A的化学式是Cl2,故答案为:Cl2;
(2)第①步骤作中加入AgNO3溶液时发生的主要反应是碘离子和银离子生成碘化银沉淀,离子方程式为:AgNO3+NaI=AgI↓+NaNO3,
故答案为:AgNO3+NaI=AgI↓+NaNO3 ;
(3)Ag中可能混合有过量Fe,则第④步操作中用稀H2SO4浸洗的目的是除去未反应的Fe,
故答案为:稀H2SO4;除去未反应的Fe;
(4)由流程图可看出,副产物为Ag,由于加入的Fe过量,所以在甲中先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液,所以Ag可循环利用,
故答案为:Ag.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 8个中子的碳原子的核素符号:12C | B. | HF的电子式: | ||
| C. | 氯化镁  | D. | Cl-离子的结构示意图: |
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. | 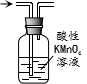 除去甲烷中少量的乙烯得纯净甲烷 |
| A. | CH≡CH+H2O $→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O $→_{△}^{NaOH}$ C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$→_{△}^{催化剂}$CH3COOH+CH3OH |
| A. | I-Fe3+ Na+ | B. | Al3+Ba2+HCO3- | C. | K+Na+CO32- | D. | NH4+K+OH- |
| 离子 | 开始沉淀 | 沉淀完全 |
| Zn2+ | 5.7 | 6.2 |
| Mn2+ | 8.2 | 9.7 |
(1)该电池的正极反应为MnO2+e-+H+═MnOOH,总反应为Zn+2MnO2+2H+═Zn2++2MnOOH.
(2)该电池中转移0.2mol电子时,消耗MnO2的质量为17.4g.
(3)将该电池的负极材料和MnO2与足量的浓盐酸共热,其中MnO2参与反应的离子方程式为MnO2+4H+(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;欲使Mn2+和Zn2+分离,需调整pH为6.2≤pH<8.2,可以加入Mn(OH)2调节pH.
(4)再继续调大pH可得到Mn(OH)2,该沉淀在空气中可以迅速被氧化成MnO2,写出此反应的化学方程式2Mn(OH)2+O2=2MnO2+2H2O.
(5)根据Mn2+沉淀完全的pH可以求得Mn(OH)2的Ksp约为10-24.4.
 ,该有机化合物属于( )
,该有机化合物属于( )①芳香烃 ②芳香族化合物 ③醇④羧酸 ⑤酯 ⑥醛 ⑦烃的衍生物⑧不饱和有机物⑨多官能团有机物.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤⑥⑦ | D. | ②③④⑥⑦⑧⑨ |

| A. | 该装置电流表中没有电流通过 | |
| B. | 铝箔是正极 | |
| C. | 总反应为4Al+3O2+6H2O═4Al(OH)3 | |
| D. | 电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
