题目内容
19.实验室制备Al(OH)3沉淀,最适宜的方法是( )| A. | AlCl3溶液中加入NaOH溶液 | B. | AlCl3溶液中加入足量的氨水 | ||
| C. | AlCl3溶液中加入石灰水 | D. | Al2O3溶于足量的热水中 |
分析 Al(OH)3属于两性氢氧化物,能溶于强酸和强碱,但不能溶于弱碱,所以实验室用弱碱和可溶性铝盐制取氢氧化铝.
解答 解:A.NaOH溶液为强碱溶液,能将氢氧化铝溶解,会导致Al元素利用率降低,故A错误;
B.氨水属于弱碱,能和氯化铝反应生成氢氧化铝沉淀,且氢氧化铝不溶于氨水,所以氨水最适宜,故B正确;
C.氢氧化钙溶解度较小且是强碱,不易作为沉淀剂,故C错误;
D.Al2O3难溶于水,与水不反应,故D错误.
故选B.
点评 本题以选择沉淀剂为载体,考查铝的重要化合物的性质,难度不大,意在考查氢氧化铝的两性这一特性.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
14.溶液、胶体和浊液这三种分散系的本质区别是( )
| A. | 是否是大量分子或离子的集合体 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |
17.在基态多电子原子中,关于核外电子能量的叙述错误的是( )
| A. | 同一能层的px、py、pz轨道电子能量相同 | |
| B. | 3d3表示3d能级有3个轨道 | |
| C. | p轨道电子能量不一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
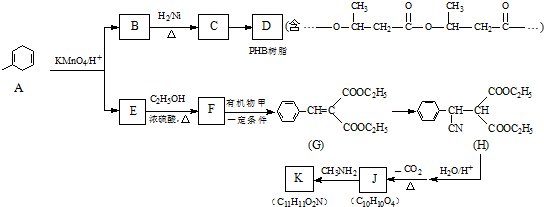
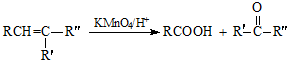
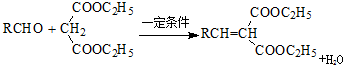
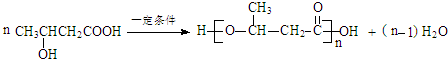 :.
:. .
.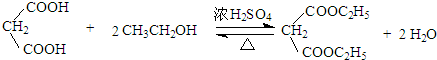 .
.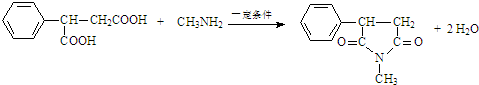 .
.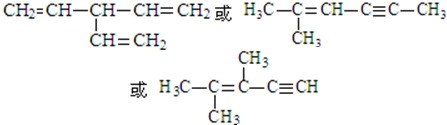 .
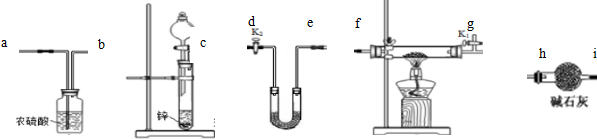
.
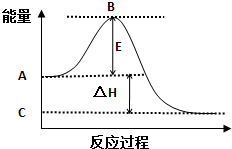 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol. 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验. 【化学-选修3物质结构与性质】
【化学-选修3物质结构与性质】