题目内容
7.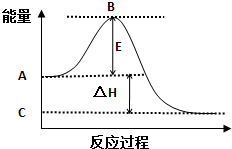 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.请回答下列问题:
①图中A点表示:反应物总能量,C点表示:生成物总能量,E的大小对该反应的反应热无(填“有”或“无”)影响.
②图中△H=-198kJ/mol.
分析 (1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
故答案为:反应物总能量、生成物总能量;无;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,故答案为:-198.
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是( )
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 充电时锌极与外电源正极相连 | |
| C. | 放电时每转移3 mol电子,正极有1mol K2FeO4被还原 | |
| D. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4 H2O |
15.室温下,用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )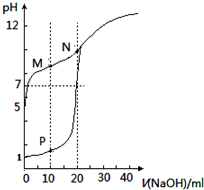

| A. | 滴定时均可用酚酞作指示剂 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液混合,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | 向N点的溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-) |
19.实验室制备Al(OH)3沉淀,最适宜的方法是( )
| A. | AlCl3溶液中加入NaOH溶液 | B. | AlCl3溶液中加入足量的氨水 | ||
| C. | AlCl3溶液中加入石灰水 | D. | Al2O3溶于足量的热水中 |
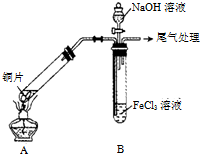 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
 、加聚反应
、加聚反应 、加成反应
、加成反应 、取代反应.
、取代反应.