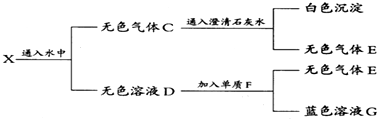
题目内容
16.甲、乙两烧杯中分别盛有100mL、1mol•L-1的硫酸溶液和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=5:6,则加入铝粉的质量为( )| A. | 2.16g | B. | 1.08g | C. | 2.7g | D. | 5.4g |
分析 根据铝的质量相同,硫酸和氢氧化钠溶液中溶质的物质的量相同,应结束后测得生成的气体体积比为甲:乙=5:6,由化学反应方程式2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸与金属反应时酸不过量,碱与金属反应时碱过量,以此来计算解答.
解答 解:硫酸和氢氧化钠溶液中溶质的物质的量均为0.1L×1mol/L=0.1mol,又两烧杯中分别加入等质最的铝粉,反应结束后测得生成的气体体积比为甲:乙=5:6,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6H+═2Al3++3H2↑
6 3
0.2mol x
解得x=0.1mol,
一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.1mol×$\frac{6}{5}$=0.12mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.12mol
解得y=$\frac{2×0.12mol}{3}$=0.08mol,
则铝的质量为0.08mol×27g/mol=2.16g,
故选A.
点评 本题考查Al的化学性质及利用化学反应方程式的计算,把握铝与酸、碱反应水的化学反应方程式,酸碱足量、酸碱均不足量时得到的氢气的关系是解答本题的关键,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
6. 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑦ |
7.设NA为阿伏加德罗常数,则下列叙述正确的是( )
| A. | 0.1mol苯分子中含有0.3NA个碳碳双键 | |
| B. | 1L 1mol/L碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L己烷中含有的分子数共为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92 NA |
4.不能证明HA是弱酸的是( )
| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |
11.下列物质中,不能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色的是( )
| A. | C2H4 | B. | C6H6 | C. | C8H18 | D. | C2H2 |
1.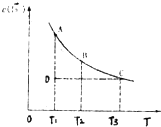 已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
 已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A的c (I2)比状态D的小 | |
| C. | A点对应的反应速率大于C点对应的反应速率 | |
| D. | 其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点 |
8.下列物质中可以导电,但不属于电解质的是( )
| A. | 金属钠 | B. | 液态HCl | C. | 熔融KCl | D. | 蔗糖溶液 |
6.下列各组物质中,互为同素异形体的是( )
| A. | SO2 SO3 | B. | CO CO2 | C. | Na2O Na2O2 | D. | O2 O3 |