题目内容
1.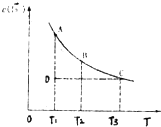 已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A的c (I2)比状态D的小 | |
| C. | A点对应的反应速率大于C点对应的反应速率 | |
| D. | 其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点 |
分析 A. 通过温度对化学平衡的影响判断反应的焓变;
B.减小I3-的浓度,化学平衡逆向移动;
C.温度越高化学反应速率越快;
D.其他条件不变,向溶液中加入KI固体,增大了I-的浓度,平衡正向移动.
解答 解:A、由图象曲线的变化趋势可知,当温度升高时,I3-的物质的量浓度减小,平衡逆向移动,说明该反应的正反应为放热反应,反应I2(aq)+I-(aq)?I3-(aq)的△H<0,故A错误;
B.D点相对于A点而言I3-的浓度较小,减小I3-的浓度,化学平衡逆向移动,c (I2)增大,故B正确;
C.C点对应的温度大于A点,温度越高化学反应速率越快,故C错误;
D.其他条件不变,向溶液中加入KI固体,增大了I-的浓度,平衡正向移动,I3-的浓度增大,故D错误;
故选B.
点评 本题考查化学平衡移动图象问题,难度中等,侧重于外界条件对化学平衡的影响,注意图象曲线上各点都表示平衡状态.

练习册系列答案
相关题目
11.关于实验事故或药品的处理方法中,正确的是( )
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| C. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加几片碎瓷片 | |
| D. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 |
12.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-=Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
16.甲、乙两烧杯中分别盛有100mL、1mol•L-1的硫酸溶液和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=5:6,则加入铝粉的质量为( )
| A. | 2.16g | B. | 1.08g | C. | 2.7g | D. | 5.4g |
6.下列说法不正确的是( )
| A. | 探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 | |
| B. | 用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)分别为中和滴定实验和pH试纸 |
13.下列有关平衡常数的说法正确的是( )
| A. | 温度越高,K值越大 | B. | K值越大,正反应速率越大 | ||
| C. | K值的大小与起始浓度有关 | D. | K值越大,反应物的转化率越大 |
10.下列有关试剂的保存方法,不正确的是( )
| A. | 浓硝酸保存在棕色试剂瓶中 | B. | 少量金属钠可保存在煤油里 | ||
| C. | 新制氯水保存在棕色试剂瓶中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |

 ;D
;D .
.
 +nH2O.
+nH2O.