题目内容
14.化学与生产、生活等密切相关.下列说法不正确的是( )| A. | 使用合成聚碳酸酯可降解塑料,可以减少“白色污染” | |
| B. | 用蘸有浓氨水的棉棒可以检验输送氯气的管道是否漏气 | |
| C. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| D. | 推广矿物燃料脱硫脱硝技术,能有效减少二氧化硫和氮氧化物的排放 |
分析 A.聚乙烯、聚氯乙烯塑料不能降解,能引起白色污染;
B.氨气与氯气反应生成氯化铵白色固体和氮气;
C.秸秆露天焚烧能够引起大量粉尘污染;
D.二氧化硫、氮的氧化物排放能够引起空气污染.
解答 解:A.使用合成聚碳酸酯可降解塑料,可以减少“白色污染”聚乙烯、聚氯乙烯塑料的使用,能够减少“白色污染”,故A正确;
B.氨气与氯气反应生成氯化铵白色固体和氮气,产生大量白烟,可以检验输送氯气的管道是否漏气,故B正确;
C.秸秆露天焚烧能够引起大量粉尘污染,引起环境污染,故C错误;
D.推广矿物燃料脱硫脱硝技术,能有效减少二氧化硫和氮氧化物的排放,减少酸雨的形成,故D正确;
故选:C.
点评 本题考查了生活中的化学,侧重考查环境污染与治理,涉及白色污染、酸雨等,题目难度不大,注意对相关知识的积累.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
4.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ•mol-1)
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1.
(2)写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式2H2(g)+S2(g)═2H2S(g)△H=-229kJ•mol-1.
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1.
(2)写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式2H2(g)+S2(g)═2H2S(g)△H=-229kJ•mol-1.
5.S-诱抗素可保证盆栽鲜花盛开,其分子结构如图,下列说法正确的是( )
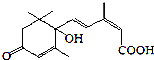

| A. | 该物质的分子式为C15H22O4 | |
| B. | 该物质环上的二氯代物共有3种 | |
| C. | 1mol该物质最多能与2 mol NaOH完全反应 | |
| D. | 该物质能发生取代、加成、氧化等反应 |
2.下列说法正确的是( )
| A. | 蔗糖在人体内水解的最终产物是葡萄糖 | |
| B. | 蔬菜水果属于碱性食物,对人体健康有益 | |
| C. | 为了防止蛋白质发生盐析,疫苗等生物制剂要冷藏 | |
| D. | 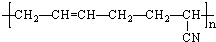 由CH2=CH2与CH2=CH-CN加聚而成 由CH2=CH2与CH2=CH-CN加聚而成 |
9.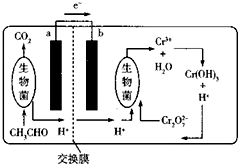 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
6.我国磷矿储量占世界第二位,主要矿物为磷灰石[(Ca3(PO4)2)].下图是生产化肥磷铵[(NH4)3PO4]并联产水泥的工艺流程.
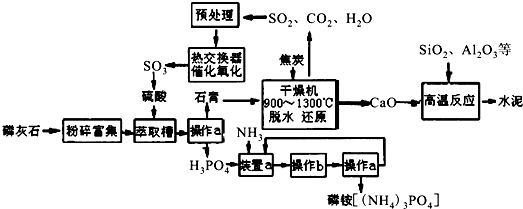
(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
①实际生产中,SO2的催化氧化反应是在常压、400℃~500℃条件下进行.采用常压的主要原因是常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;该反应化学平衡常数大小关系是:K(400℃)> K(500℃)(填“>”、“<”或“=”).
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.

(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.
3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | c(I-)=0.1mol•L-1的溶液中:Na+、Mg2+、ClO-、SO42- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl- | |
| D. | 由水电离产生的c(OH-)=1×10-10 mol•L-1的溶液中:Ba2+、K+、NO3-、Br- |
12.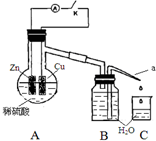 该同学用如下装置进行实验,分析影响反应速率的因素.
该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示.下列说法不正确的是( )
 该同学用如下装置进行实验,分析影响反应速率的因素.
该同学用如下装置进行实验,分析影响反应速率的因素.| 实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
| 实验Ⅱ(闭合K)1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
| A. | 实验Ⅰ中化学能主要转化为热能 | |
| B. | 实验Ⅱ中化学能主要转化为电能 | |
| C. | 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率 | |
| D. | 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ |
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.