题目内容
18.化学与生活、生产密切相关.下列叙述错误的是( )| A. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| B. | 向海水中加净水剂明矾可使海水淡化 | |
| C. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| D. | 服用抗氧剂维生素C有利于人体对铁元素的吸收 |
分析 A.过氧化钠与水、二氧化碳反应都产生氧气;
B.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物;
C.原电池能加快化学反应的速率;
D.维生素具有还原性,能够还原三价铁离子.
解答 解:A.过氧化钠与二氧化碳或水反应生成氧气,则过氧化钠可用作潜艇供氧剂,故A正确;
B.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物,不能除去可溶性盐类,不能使海水淡化,故B错误;
C.氯化钙是电解质,能与桥梁中的钢构成原电池,故C正确;
D.维生素具有还原性,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁元素的吸收,故D正确;
故选:B.
点评 本题考查了物质的用途,熟悉过氧化钠、明矾、维生素性质,明确金属电化学腐蚀原理是解题关键,题目难度不大.

练习册系列答案
相关题目
9.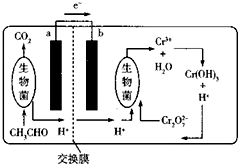 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
6.我国磷矿储量占世界第二位,主要矿物为磷灰石[(Ca3(PO4)2)].下图是生产化肥磷铵[(NH4)3PO4]并联产水泥的工艺流程.
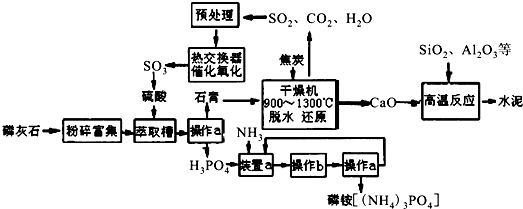
(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
①实际生产中,SO2的催化氧化反应是在常压、400℃~500℃条件下进行.采用常压的主要原因是常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;该反应化学平衡常数大小关系是:K(400℃)> K(500℃)(填“>”、“<”或“=”).
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.

(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.
13.向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液,下列说法正确的是( )
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | c(I-)=0.1mol•L-1的溶液中:Na+、Mg2+、ClO-、SO42- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl- | |
| D. | 由水电离产生的c(OH-)=1×10-10 mol•L-1的溶液中:Ba2+、K+、NO3-、Br- |
10.在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示有、无催化剂时反应的能量变化,图2表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系.下列叙述正确的是( )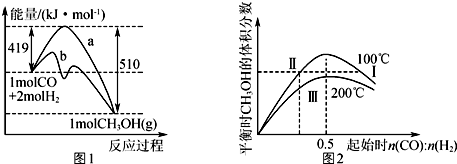

| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
16.对于反应:2SO2+O2?2SO3,下列说法不正确的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 通入过量的O2可以使SO2转化率达到100% | |
| C. | 升高温度可以增大反应速率 | |
| D. | 增大O2浓度可以增大反应速率 |
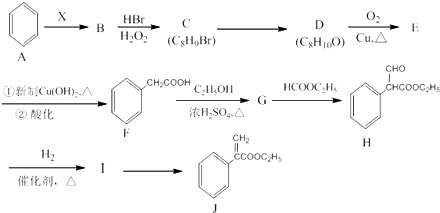
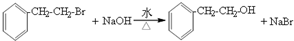 .
.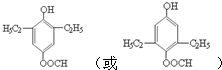 (任写一种即可).
(任写一种即可).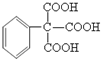 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).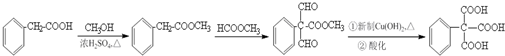 .
.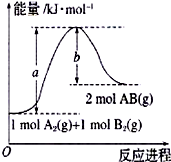 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.