题目内容
用标准溶液NaOH滴定未知浓度的盐酸,以下操作会造成测定结果偏低的是( )
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
考点:化学实验方案的评价
专题:实验评价题
分析:根据c(待测)=
分析不当操作对相关物理量的影响,以此判断浓度的误差.
| c(标准)×V(标准) |
| V(待测) |
解答:
解:A.固NaOH体中混有NaCl 杂质,所配得溶液的OH-浓度偏小,造成V(碱)偏大,导致滴定浓度偏大,故A错误;
B.滴定终点读数时,俯视滴定管的刻度,导致标准液体积偏小,则测定结果偏低,故B正确;
C.滴定管无需润洗,未用未知液体润洗,对实验结果无影响,故C错误;
D.配制NaOH标准溶液时,定容时俯视刻度线,导致标准液浓度偏大,则滴定时所用标准液体积偏小,测定结果偏小,故D正确.
故选BD.
B.滴定终点读数时,俯视滴定管的刻度,导致标准液体积偏小,则测定结果偏低,故B正确;
C.滴定管无需润洗,未用未知液体润洗,对实验结果无影响,故C错误;
D.配制NaOH标准溶液时,定容时俯视刻度线,导致标准液浓度偏大,则滴定时所用标准液体积偏小,测定结果偏小,故D正确.
故选BD.
点评:本题主要考查酸碱滴定实验的基本操作,为高频考点,侧重于学生的分析能力和实验能力的考查,难度不大,学生应注意操作的规范性和实验中常见的误差分析.

练习册系列答案
相关题目
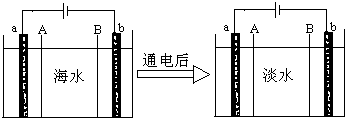 电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A、通电后,海水中阳离子往a电极处运动 |
| B、B膜是阴离子交换膜 |
| C、通电后,电子由b极经过溶液到达a极 |
| D、通电后,b电极上产生无色气体,溶液中少量白色沉淀 |
 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答: