题目内容
某粗盐中含有Ca2+、Mg2+及SO42-,除去杂质离子所加入的试剂及顺序可以是(填序号):
试剂①NaOH、试剂② 、试剂③ 、试剂④ .
A.Na2CO3 B.BaCl2 C.HCl D.AgNO3
在加试剂③后,应先进行一个实验操作 ,之后再加入试剂④.
试剂①NaOH、试剂②
A.Na2CO3 B.BaCl2 C.HCl D.AgNO3
在加试剂③后,应先进行一个实验操作
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:粗盐中含有Ca2+、Mg2+及SO42-,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,以此来解答.
解答:
解:先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂①为NaOH,②为BaCl2,③为Na2CO3,④为HCl,加试剂③后,杂质离子转化为沉淀,则应先进行一个实验操作为过滤,
故答案为:BaCl2;Na2CO3;HCl;过滤.
故答案为:BaCl2;Na2CO3;HCl;过滤.
点评:本题考查混合物分离提纯的实验设计,为高频考点,把握分离发生的反应及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.

练习册系列答案
相关题目
用标准溶液NaOH滴定未知浓度的盐酸,以下操作会造成测定结果偏低的是( )
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
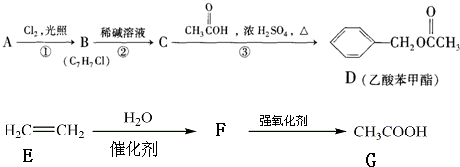
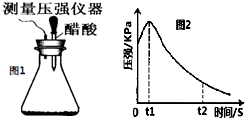 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
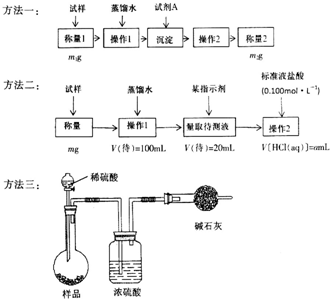 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法. 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题: