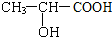题目内容
工业上用氯气通入冷的石灰乳反应制漂白粉,若要制得含有效成分1.43千克的漂白粉,理论上需标准状况下氯气多少升.
考点:化学方程式的有关计算
专题:计算题
分析:漂白粉的有效成分为Ca(ClO)2,已知Ca(ClO)2为1.43千克,根据方程式计算出氯气的物质的量,再求出标准状况下氯气的体积.
解答:
解:漂白粉的有效成分为Ca(ClO)2,已知Ca(ClO)2为1.43千克,则Ca(ClO)2的物质的量为
=
=10mol,
已知2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,每当生成1molCa(ClO)2消耗2mol氯气,则制备10mol1molCa(ClO)2消耗20mol氯气,
则氯气的体积为20mol×22.4L/mol=448L.
答:理论上需标准状况下氯气448升.
| m |
| M |
| 1.43×103g |
| 143g/mol |
已知2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,每当生成1molCa(ClO)2消耗2mol氯气,则制备10mol1molCa(ClO)2消耗20mol氯气,
则氯气的体积为20mol×22.4L/mol=448L.
答:理论上需标准状况下氯气448升.
点评:本题考查物质的量的有关计算、气体摩尔体积有关计算等,题目比较基础,注意漂把握白粉的有效成分以及漂白粉的制备原理.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
下列说法中不正确的是( )
①由同一种元素组成的物质是单质.
②阴离子不含金属元素,阳离子含金属元素.
③金属氧化物一定是碱性氧化物.
④碱性氧化物一定是金属氧化物.
⑤非金属氧化物一定是酸性氧化物.
⑥酸性氧化物一定是非金属氧化物.
⑦酸酐一定是氧化物.
⑧酸的元数不一定等于酸中的H原子数.
⑨无氧酸不一定是非金属的氢化物.
①由同一种元素组成的物质是单质.
②阴离子不含金属元素,阳离子含金属元素.
③金属氧化物一定是碱性氧化物.
④碱性氧化物一定是金属氧化物.
⑤非金属氧化物一定是酸性氧化物.
⑥酸性氧化物一定是非金属氧化物.
⑦酸酐一定是氧化物.
⑧酸的元数不一定等于酸中的H原子数.
⑨无氧酸不一定是非金属的氢化物.
| A、①②④⑤⑦⑧ |
| B、①③⑤⑧⑨ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑦⑧⑨ |
下列溶液均处于25℃,有关叙述正确的是( )
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
用标准溶液NaOH滴定未知浓度的盐酸,以下操作会造成测定结果偏低的是( )
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
下列各组物质混合后一定没有氯气生成的是( )
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |