题目内容
PH=2的醋酸与PH=12的氢氧化钠溶液等体积混合,混合后溶液PH 7(填“<”“>”或“=”).
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:pH=2的醋酸,其浓度大于0.01mol/L,pH=12的氢氧化钠,其浓度等于0.01mol/L,等体积混合后,醋酸过量,以此解答.
解答:
解:pH=2的醋酸,其浓度大于0.01mol/L,pH=12的氢氧化钠,其浓度等于0.01mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性,pH<7,
故答案为:<.
故答案为:<.
点评:本题考查酸碱混合溶液的定性分析,为高频考点,注意pH与浓度的关系,把握弱电解质的电离特点,题目难度不大.

练习册系列答案
相关题目
用标准溶液NaOH滴定未知浓度的盐酸,以下操作会造成测定结果偏低的是( )
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
下列各组物质混合后一定没有氯气生成的是( )
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
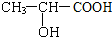
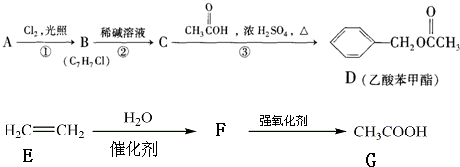
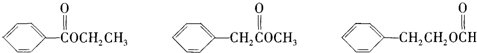
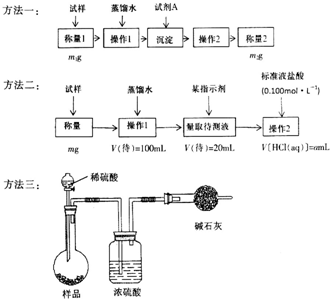 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.