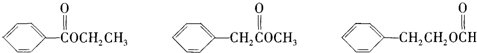题目内容
 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:(1)写出0-V1段直线发生反应的离子方程式
(2)a点的沉淀有
(3)若当V1=160ml时,则金属粉末中n(Mg)=
考点:有关混合物反应的计算
专题:计算题
分析:(1)0~V1段滴入氢氧化钠溶液后没有生成沉淀,说明硫酸过量,加入的氢氧化钠与剩余的硫酸反应生成硫酸钠和水;
(2)a点时沉淀达到最大量,说明铝离子、镁离子完全转化成氢氧化铝、氢氧化镁沉淀;b点时沉淀不再变化,说明氢氧化铝溶解,此时沉淀只有氢氧化镁;
(3)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=
计算滴入氢氧化钠溶液体积V2.
(2)a点时沉淀达到最大量,说明铝离子、镁离子完全转化成氢氧化铝、氢氧化镁沉淀;b点时沉淀不再变化,说明氢氧化铝溶解,此时沉淀只有氢氧化镁;
(3)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=
| n |
| c |
解答:
解:(1)0~V1段,滴入氢氧化钠溶液后没有生成沉淀,说明硫酸过量,滴入的氢氧化钠与硫酸反应生成硫酸钠和水,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(2)根据图象可知,a点时沉淀达到最大量,说明铝离子、镁离子完全转化成沉淀,所以此时沉淀的组成为:氢氧化铝、氢氧化镁沉淀;
b点之后沉淀不再变化,说明此时氢氧化铝完全溶解,沉淀为氢氧化镁,
故答案为:氢氧化镁、氢氧化铝;氢氧化镁;
(3)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=
n(Na+)=
n(NaOH)=
×0.16L×1mol/L=0.08mol,
设MgSO4为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1,
100mL 2mol/L的H2SO4溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,
根据SO42-离子守恒有:x+3y=0.2-0.08=0.12,
联立方程解得:x=0.06、y=0.02,
所以金属粉末中:n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol+0.04mol=0.44mol,
则V2=
=0.44L=440mL,
故答案为:0.06;440.
故答案为:H++OH-=H2O;
(2)根据图象可知,a点时沉淀达到最大量,说明铝离子、镁离子完全转化成沉淀,所以此时沉淀的组成为:氢氧化铝、氢氧化镁沉淀;
b点之后沉淀不再变化,说明此时氢氧化铝完全溶解,沉淀为氢氧化镁,
故答案为:氢氧化镁、氢氧化铝;氢氧化镁;
(3)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
设MgSO4为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1,
100mL 2mol/L的H2SO4溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,
根据SO42-离子守恒有:x+3y=0.2-0.08=0.12,
联立方程解得:x=0.06、y=0.02,
所以金属粉末中:n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol+0.04mol=0.44mol,
则V2=
| 0.44mol |
| 1mol/L |
故答案为:0.06;440.
点评:本题考查了有关混合物反应的计算,题目难度中等,明确图象曲线变化的含义为解答此类题的关键,注意掌握常见离子的性质及发生的反应,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
设NA代表阿伏加德罗常数的数值.下列有关叙述正确的是( )
| A、标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B、1 mol CaC2所含阴离子数为2NA |
| C、常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA |
| D、含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数为NA |
下列溶液均处于25℃,有关叙述正确的是( )
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
用标准溶液NaOH滴定未知浓度的盐酸,以下操作会造成测定结果偏低的是( )
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |